
����Ŀ����ʪ������C1-���ܽ����������ͭ����ʴ����Ҫ�������أ���ʴ���ص���ͭ�����������������õĶ�״��㡣��ͼΪ��ͭ�������绯ѧ��ʴ��ԭ��ʾ��ͼ������˵����ȷ���ǣ� ��

A.��ʴ�����У���ͭ����������
B.����64 g Cu��ʴ���������������������Ϊ11.2 L(��״��)
C.��״�����γɼ�������ͭ���ĸ�ʴ���ʣ�����Ϊ�ı��˷�Ӧ���ʱ�
D.�����е�C1-�������������������ɶ��״�⣬�����ӷ���ʽΪ2Cu2++3OH-+C1-=Cu2(OH)3C1��
���𰸡�BD
��������
A������ԭ��صĹ���������ͼ�е���Ϣ���ж���������
B����ϵ��ӵ�ʧ�غ�ȷ��ͭ�������Ĺ�ϵ��
C��������ṹ��ԭ��ط�Ӧ��Ӱ�죬ע���ʱ��Ӱ�����أ�
D����ϵ缫��Ӧ�IJ��P����ʻ����е����ӿ�ȷ����Ӧ�ķ���ʽ��
A�����ͼʾ��Ϣ��֪��ͭ�����е�ͭʧȥ���ӱ�ΪCu2+��ʧ����ӦΪԭ��صĸ�������ʴ�����У���ͭ�����Ǹ�����A����
B������������Ӧ��Cu-2e-=Cu2+��64 gͭ�����ʵ���Ϊ1 mol��n(e-)=2 mol��������O2�õ��ӷ�����ԭ��Ӧ��O2+2H2O+4e=4OH��������������ʧ����������ȣ���Ӧ����O2�����ʵ���Ϊn(O2)=![]() mol=0.5 mol�����ڱ���µ����Ϊ11.2 L��B��ȷ��
mol=0.5 mol�����ڱ���µ����Ϊ11.2 L��B��ȷ��
C����״�����γɼ�������ͭ���ĸ�ʴ������Ҫ����Ϊ������������ṹ�ܹ�����Ӧ����缫�ĽӴ�����Ӽӿ��˷�Ӧ���ʣ����Է�Ӧ���ʱ�û��Ӱ�죬C����
D������������Ӧ��Cu-2e-=Cu2+�����������õ��ӷ�����Ӧ��O2+2H2O+4e=4OH����������������������Һ�������ӽ������Cu2(OH)3Cl�������ӷ���ʽΪ��2Cu2++3OH-+Cl-=Cu2(OH)3Cl����D��ȷ��
�ʺ���ѡ����BD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��������Ժ����Ҫ�Ļ���ԭ�ϣ���;�㷺���ش��������⣺
��֪��I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ��H1=-206.6kJmo1-1
(g) ��H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O��1�� ��H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O��1�� ��H3
(g)+5O2(g)=4CO2(g)+4H2O��1�� ��H3
��1����ӦIII����S(����>����<������=��)___0��
��2����ֵ�DZ�ʾ��λ������ȼ����ȫȼ��ʱ���ų�����������ȼ��������һ����Ҫָ�ꡣ��֪��ϩ����ֵΪ50.4kJg-1�����H3=___kJmol-1
��3��ʵ����2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)��v��=k��c2(
(g)�У�v��=k��c2(![]() ����v��=k��c2(CH2=CH2)c(O2)(k����k��Ϊ���ʳ�����ֻ���¶��йأ���
����v��=k��c2(CH2=CH2)c(O2)(k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٷ�Ӧ�ﵽƽ��������¶ȣ�����˵����ȷ������________��
A.k����k����������k������ı�������
B.k����k���ȼ�С����k����С�ı�������
C.k������k����С��ƽ�������ƶ�
D.k����k������С����k����С�ı�������
������1L���ܱ������г���1molCH2=CH2(g)��1molO2(g)����һ���¶���ֻ������ӦI������10min��Ӧ�ﵽƽ�⣬��ϵ��ѹǿ��Ϊԭ����0.875������0~10min��v(O2)=___��![]() =___��
=___��
��4���ִ��Ʊ���ϩ�������������ѽⷨ��
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ��H2=-110kJmol-1����Ӧ�л�����CH4��CO��CO2�ȸ��������Ӧ��Ϊ���ȷ�Ӧ����ͼ1Ϊ�¶ȶ����������ѽⷴӦ���ܵ�Ӱ�졣
O2(g)=C2H4(g)+H2O(g) ��H2=-110kJmol-1����Ӧ�л�����CH4��CO��CO2�ȸ��������Ӧ��Ϊ���ȷ�Ӧ����ͼ1Ϊ�¶ȶ����������ѽⷴӦ���ܵ�Ӱ�졣
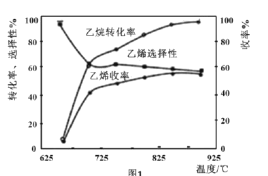
�������ת�������¶ȵ����߶����ߵ�ԭ����___����Ӧ������¶�Ϊ___������ţ���
A.650�� B.700�� C.850�� D.900��
����ϩѡ����=![]() ����ϩ����=����ת���ʡ���ϩѡ���ԣ�
����ϩ����=����ת���ʡ���ϩѡ���ԣ�
�ڹ�ҵ�ϣ�������ϵ��ѹ�㶨Ϊl00kPa�������½��и÷�Ӧ��ͨ��������������Ļ�������в���������壨����������������Ϊ70%)��������������Ŀ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�NOCl)��һ�ֺ��ɫҺ����ɫ���壬�۵�-64.5�棬�е�-5.5�棬��ˮ��ˮ�⡣�����л��ϳ��е���Ҫ�Լ�������NO��Cl2�ڳ��³�ѹ�ºϳɣ�ij��ѧ��ȤС�������ͼװ���Ʊ�NOC1���ش�����������⣺
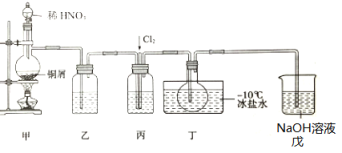
��1��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ��NOCl�ĵ���ʽΪ___��
��2��װ�����е�Һ��Ϊ___��װ�ñ�������___��
��3��ʵ��ʱ����ͨ��Cl2���۲쵽������ƿ�ڳ�������ɫ����ʱ����ͨ��NO����������Ŀ����___����������ƿ����һ����Һ������ʱ��ֹͣʵ�顣
��4)����װ�������һ����֮����������___���û�ѧ����ʽ��ʾ)��
��5���ⶨNOCl�Ĵ��ȣ�ȡ���ò���a g����ˮ�����Ƴ�250mL��Һ��ȡ25.00mL����ƿ�У���K2Cr2O7��ҺΪָʾ������c mol��L-1 AgNO3����Һ�ζ����յ㣬���ı���Һ�����Ϊ24.00mL���ζ��յ��������___���������ȣ�NOCl���Ĵ���Ϊ___����Ag2CrO4ש��ɫ��Ksp(AgCl)=1.56x10-10��Ksp(Ag2CrO4)=1.0x10-12��Ksp(AgNO2)=5.86��10-4)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ����3mol A��2mol B����ͨ�����Ϊ2L���ܱ������У��ݻ����䣩��������Ӧ��3A(g) + xB(g)![]() C(g)��4minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ��0.4 mol B�������C��Ũ��Ϊ0.4mol/L������д���пհף�
C(g)��4minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ��0.4 mol B�������C��Ũ��Ϊ0.4mol/L������д���пհף�
��1��x=_________��
��2����A��ʾ�÷�Ӧ������Ϊ____________________mol/(L��min)��
��3����������ƽ�������������ͨ������������������A��B��C������Ӧ��������˵������ȷ����______________________����д����ѡ����ĸ���ţ���
A.��ѧƽ��������Ӧ�����ƶ�
B.��ѧƽ�����淴Ӧ�����ƶ�
C.��ѧƽ�ⲻ�ᷢ���ƶ�
D.�����淴Ӧ�Ļ�ѧ��Ӧ���ʽ�����ͬ�ȳ̶ȵĸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)��1.8��10��10��Ksp(AgI)��1.5��10��16��Ksp(Ag2CrO4)��2.0��10��12�������������εı�����Һ�У�Ag��Ũ�ȴ�С˳����ȷ����(����)
A. AgCl��AgI��Ag2CrO4 B. AgCl��Ag2CrO4��AgI
C. Ag2CrO4��AgCl��AgI D. Ag2CrO4��AgI��AgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ��CaCO3��Ksp=2.8��10-9���ֽ�Na2CO3Ũ��Ϊ2��10-4mol��L-1��Na2CO3��Һ��CaCl2��Һ������������Ҫ����������������CaCl2��Һ��Ũ������Ӧ����
A. 2.8��10-2mol��L-1 B. 5.6��10-5mol��L-1
C. 2.8��l0-5 mol��L-1 D. 1.4��l0-5mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Լ���ͼʾװ���ܹ���ȡ��Ӧ������ǣ��г������ԣ�
A | B | C | D |
| |
X���Լ� | ˮ | Ũ���� | ˫��ˮ | ��ˮ | |
Y���Լ� | Fe | MnO2 | MnO2 | NaBr | |
���� | H2 | Cl2 | O2 | Br2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ����������������й㷺���ڡ�
��1���Ȱ���NH2Cl���ĵ���ʽΪ___����ͨ����ӦNH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)�Ʊ��Ȱ�����֪���ֻ�ѧ���ļ��������ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ����H=___��
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����/(kJ��mol-1) | 391 | 243 | 191 | 431 |
��2��Һ���д��ڵ���ƽ��2NH3(l)![]() NH
NH![]() +NH
+NH![]() ����Pt�缫��Һ�����е��Ҳ�ɲ���H2��N2�������ĵ缫��Ӧʽ��___��
����Pt�缫��Һ�����е��Ҳ�ɲ���H2��N2�������ĵ缫��Ӧʽ��___��
��3���ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400����400����T���������зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯��������ʾ��
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400����400����T���������зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯��������ʾ��
t/min | 0 | 20 | 40 | 60 | 80 |
n(NO)����������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)����������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)����������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ٸ÷�ӦΪ___��������������������������Ӧ��������___��
������ѡ���п���˵���������Ѿ��ﵽƽ��״̬����___������ţ�
A.������ѹǿ����
B.������������ܶȲ���
C.2����(NO)=����(N2)
D.��������ƽ��Ħ����������
����������100min�ﵽƽ��״̬����0��100min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ������(NO)=___��ƽ�ⳣ��K(400��)=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MOF����̼���װ���װ�������������CO2�绯ѧ����ȡHCOOH���п��ٸ�Ч��ѡ���ԡ���ԭ��ͼ��ͼ�������й�˵����ȷ����

A.�÷�������Ч����CO2�Դ�����ɵ���Ⱦ
B.�õ缫Ӧ���Դ����������
C.�õ缫��ӦʽΪ��CO2��2e-+2H+=HCOOH
D.ѡ��ʹ�������������ܵõ�HCHO��CH3OH�Ȳ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com