
| A、共价键极性CCl4>SiCl4 |
| B、沸点CH3CH2OH>CH3CH2Cl |
| C、元素的电负性Ca>Mg |
| D、晶格能KCl>NaCl |


科目:高中化学 来源: 题型:
| A、离子半径:F->Na+>Mg2+>Al3+ |
| B、热稳定性:HCl>H2S>PH3>AsH3 |
| C、酸性强弱:H3AlO3<H4SiO4<H2CO3<H3PO4 |
| D、沸点:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维生素C是水溶性的,在洗菜时容易损失 |
| B、维生素C怕高温,加热时间过长会破坏 |
| C、维生素C具有还原性,含维生素C的蔬菜存放的时间越长,维生素C的损失越大 |
| D、水溶性维生素不易被人体吸收,所以容易缺乏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态HBr不导电,因此HBr是非电解质 |
| B、强电解质溶液的导电性不一定很强 |
| C、NH3的水溶液能导电,因此NH3是电解质 |
| D、强电解质在液态时一定能导电 |
| E、强电解质在液态时一定能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾霾的主要组成是二氧化硫、氮氧化物和可吸入颗粒物 |
| B、垃圾是放错地方的资源,应分类回收利用 |
| C、光导纤维是一种无机非金属材料,现已广泛应用于太阳能电池的生产 |
| D、14C可用于文物的年代鉴定,14C和12C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
| B、NH3易液化 |
| C、HF、HCl、HBr、HI的热稳定性依次减弱 |
| D、H2S的熔沸点低于H2O的熔、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
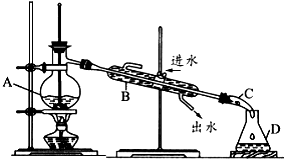
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com