
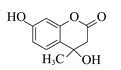
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知: 
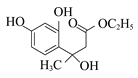
(1)A属于芳香烃,其结构简式是______。B中所含的官能团是______。
(2)C→D的反应类型是______。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______。
(4)已知:![]() 。F所含官能团有
。F所含官能团有![]() 和______。
和______。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
__________________,__________________,__________________,__________________。

【答案】![]() 硝基取代反应
硝基取代反应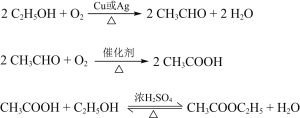
![]()
![]()
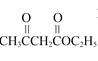
【解析】
由羟甲香豆素结构简式可知D为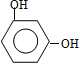 ,则C为
,则C为![]() ,B为
,B为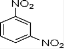 ,则A为
,则A为![]() ;由题中信息(3)可知E为CH3COOCH2CH3,由
;由题中信息(3)可知E为CH3COOCH2CH3,由![]() ,可知F为CH3CH2OOCCH2COCH3;以D和F为原料,生成中间产物1为
,可知F为CH3CH2OOCCH2COCH3;以D和F为原料,生成中间产物1为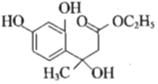 ,为加成反应,然后生成中间产物2为
,为加成反应,然后生成中间产物2为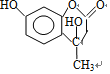 ,发生的为酯交换反应,即信息2反应,最后发生消去反应可生成羟甲香豆素。
,发生的为酯交换反应,即信息2反应,最后发生消去反应可生成羟甲香豆素。
(1)由以上分析可知A为![]() ,B为
,B为![]() ,含有的官能团为硝基;(2)C为
,含有的官能团为硝基;(2)C为![]() ,发生取代反应生成
,发生取代反应生成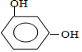 ;
;
(3)E为CH3COOCH2CH3,可由乙酸和乙醇发生酯化反应生成,若仅以乙醇为有机原料,需要乙醇氧化为乙醛、乙醛氧化为乙酸,需要方程式为![]() 、
、![]() 、 CH3COOH+CH3CH2OH
、 CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;(4)F为CH3CH2OOCCH2COCH3,含有的官能团为
CH3COOCH2CH3+H2O;(4)F为CH3CH2OOCCH2COCH3,含有的官能团为![]() 和
和![]() ;(5)以D和F为原料,生成中间产物1为
;(5)以D和F为原料,生成中间产物1为 ,为加成反应,然后生成中间产物2为
,为加成反应,然后生成中间产物2为 ,发生的为酯交换反应,即信息2反应,最后发生消去反应可生成羟甲香豆素。
,发生的为酯交换反应,即信息2反应,最后发生消去反应可生成羟甲香豆素。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.实验室制乙炔时可用CuSO4除杂质气体
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替
D.乙炔的收集方法可用排空气法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验制备2-羟基-4-苯基丁酸乙酯,反应原理、装置和数据如下:


相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
乙醇 | 46 | 0.789 | 78.4 | 易溶 |
2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
实验步骤:
①如图1,在干燥的圆底烧瓶中加入20mL2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品。
请回答下列问题:
(1)油水分离器的作用为____________________。实验过程中发现忘记加沸石该如何操作_______________________。
(2)本实验采用____________加热方式(填“水浴”、“油浴”或“酒精灯加热”)。
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤。第二次水洗的目的是___________________。
(4)在精制产品时,加入无水MgSO4的作用为___________________;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有__________________________。
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g。则该实验的产率为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
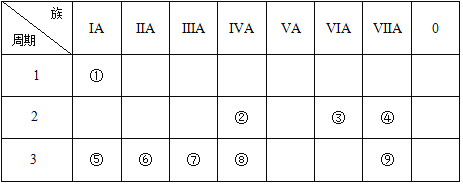
(1)表中用于半导体材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半径最小是__________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答)。
(5)②和③按原子数1:2形成的化合物的电子式为____,该晶体气化的过程中克服的微粒间作用力为______。
(6)③和⑧形成的化合物属于__________(填“离子化合物”或“共价化合物”),该晶体属于__________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
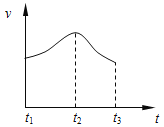
【题目】Ⅰ、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是_____________。
(2)实验②放出氢气的量减少的原因是_____________。(用离子方程式表示)
(3)实验③反应速率加快的主要原因是___________。
II、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
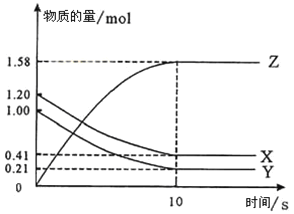
(1)写出该反应的化学方程式_______________。
(2)反应开始到10s,用X表示的反应速率是__________。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
a. 当X与Y的反应速率之比为1:1
b. 混合气体中X的质量分数保持不变
c. X、Y、Z的浓度之比为1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。

下列说法不正确的是
A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在0~10min之间,实验②的平均速率v(Y)=0.04molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化中:①碘升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤过氧化钠溶于水 ⑥氯化铵受热分解 ⑦氧气溶于水
其中:(填序号)未发生化学键破坏的是_______;仅发生离子键破坏的是______;仅发生共价键破坏的是_______;既发生离子键破坏,又发生共价键破坏的是___________。
(2)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
①此时,A的浓度为__________________;
②反应开始前放入容器中B的物质的量为___________;
③B的化学反应速率为_________________________;
④x值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸乙烯酯广泛用作电池电解质、酯类合成的中间体等。一种由CH2=CH2、CO2及O2为原料,在铁、铜及碘化物催化下的制备碳酸乙烯酯的反应如下:

(1)Fe2+基态核外电子排布式为____。
(2)写出一种与CO2互为等电子体的阴离子:____。
(3)碳酸乙烯酯中碳原子杂化轨道类型为____;1mol碳酸乙烯酯分子中含![]() 键数目为____。
键数目为____。
(4)FeO晶胞结构如图-1所示,晶体中与每个Fe2+紧邻的Fe2+有____个;一种由Sn、Cu、Fe及S组成的化合物的晶胞结构如图-2所示。该化合物的化学式为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com