
【题目】下列有关乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.实验室制乙炔时可用CuSO4除杂质气体
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替
D.乙炔的收集方法可用排空气法收集
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为( )
A. Ba(OH)2溶液中加入少量NaHCO3溶液:HCO3-+Ba2++OH-=BaCO3![]() +H2O
+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓
C. NH4HCO3稀溶液与过量的KOH溶液反应:HCO3-+OH-=CO32-+H2O
D. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
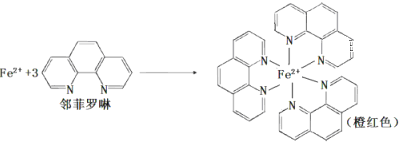
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
FeCl3+2NH2OHHCl= 4FeCl2+N2O↑+6HCl+H2O
① Fe3+在基态时,核外电子排布式_____;
② 羟胺中(NH2OH)采用sp3杂化的原子有______,三种元素电负性由大到小的顺序为______;
③ Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为____;
④N2O分子的空间构型为______(用文字描述)。
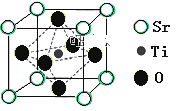
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可产生电流。钛酸锶晶体结构如图所示,则钛酸锶的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型锂电池装置,电池充、放电反应为![]()
![]()
![]() 。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
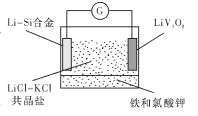
A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极的反应为xLi++xe-+LiV3O8= Li1+XV3O8
D. 充电时 Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是

A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
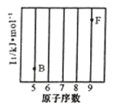
(1)参照下图 B、F 元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出 C、N、O 三 种元素的相对位置。
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为_________________ 。
(3)二卤化铅 PbX2 的熔点如图(b)所示,可推断:依 F、Cl、Br、I 次序,PbX2 中的化学键 的离子性_____( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性_____。
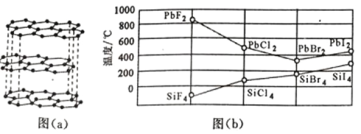
(4)NH3 和 F2 在 Cu 催化下可发生反应 4NH3+3F2 ![]() NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3 与一定量水形成(H2O)2·BF3 晶体 Q,Q 在一定条件下可转化为 R: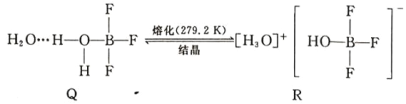 晶体 R 中含有的化学键包 括_____。
晶体 R 中含有的化学键包 括_____。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的 Ka2____________________________苯酚
,相同温度下,水杨酸的 Ka2____________________________苯酚
(![]() )的 Ka(填“>”“ =”或“<”),其原因是______________。
)的 Ka(填“>”“ =”或“<”),其原因是______________。
(7)碳的另一种单质 C60 可以与钾形成低温超导化合物,晶体结构如图(c)所示,K 位于立方体的棱上和 立方体的内部,此化合物的化学式为____________;其晶胞参数为 1.4 nm,阿伏加德罗常数用 NA 表 示,则晶体的密度为________________g·cm-3。(只需列出式子)
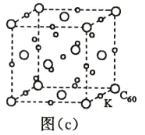
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中提供的部分短周期元素原子半径及主要化合价的信息,回答下列问题
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.104 | 0.099 | 0.066 |
主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | +7、-1 | -2 |
(1)A在元素周期表中位置是____。
(2)B的离子结构示意图:_____,
(3)C单质与A的最高价氧化物对应的水化物反应的离子方程式:____。
(4)元素最高价氧化物对应的水化物酸性最强的是:____ (写化学式)。
(5)A元素与F元素形成的化合物的电子式 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知: 
(1)A属于芳香烃,其结构简式是______。B中所含的官能团是______。
(2)C→D的反应类型是______。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______。
(4)已知:![]() 。F所含官能团有
。F所含官能团有![]() 和______。
和______。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
__________________,__________________,__________________,__________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com