
【题目】如图是一种新型锂电池装置,电池充、放电反应为![]()
![]()
![]() 。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
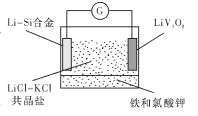
A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极的反应为xLi++xe-+LiV3O8= Li1+XV3O8
D. 充电时 Cl-移向LiV3O8电极
【答案】B
【解析】
本题考查电化学的相关知识。放电反应属于原电池,充电反应属于电解池,根据原电池和电解池的工作原理进行分析判断。由已知放电反应为![]()
![]() 原理知道锂合金一端做负极,LiV3O8做正极,发生还原反应,电极反应方程式为xLi++xe-+LiV3O8= Li1+XV3O8;充电反应属于电解池,LiV3O8电极做阳极,阴离子向阳极移动,整个反应过程中除了化学能和电能之间的相互转化,还有一部分转为热能了。就此判断每个选项即可。
原理知道锂合金一端做负极,LiV3O8做正极,发生还原反应,电极反应方程式为xLi++xe-+LiV3O8= Li1+XV3O8;充电反应属于电解池,LiV3O8电极做阳极,阴离子向阳极移动,整个反应过程中除了化学能和电能之间的相互转化,还有一部分转为热能了。就此判断每个选项即可。
A. 共晶盐是优良的传热储能介质,其熔点较低,可利用铁和氯酸钾反应放出的热量使其熔化,故A正确;B. 整个过程的能量转化有化学能转化为电能,还有化学能与热能的转化,故B错误;C. 放电时为原电池,LiV3O8电极做正极,其电极的反应式为xLi++xe-+LiV3O8= Li1+XV3O8,故C正确;D. 充电时为电解池, Cl-移向阳极LiV3O8电极移动,故D正确;答案:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:![]()
![]()
甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(2)工业合成氨的反应原理为![]() 某温度下,把10mol
某温度下,把10mol![]() 与28mol
与28mol![]() 置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为
置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为![]() ,则10min内该反应的平均速率
,则10min内该反应的平均速率![]() ______
______ ![]() ,则该温度下该反应的平衡常数
,则该温度下该反应的平衡常数![]() ______
______ ![]() 欲增大氮气的平衡转化率,可采取的措施有 ______
欲增大氮气的平衡转化率,可采取的措施有 ______ ![]() 写一种措施即可
写一种措施即可![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的分子式均为 C8H8,下列说法正确的是
的分子式均为 C8H8,下列说法正确的是
A. a、b、c 均可与酸性高锰酸钾溶液反应
B. a、b、c 的二氯代物均只有 3 种
C. a 的同分异构体中除 b、c 外,还有可与溴水反应的物质
D. a、b、c 中只有 b、c 的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和实验现象所得到的实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.实验室制乙炔时可用CuSO4除杂质气体
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替
D.乙炔的收集方法可用排空气法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
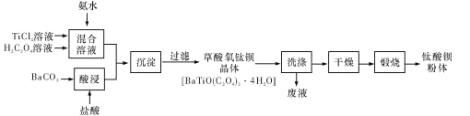
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
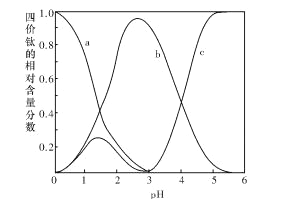
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
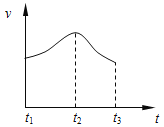
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是_____________。
(2)实验②放出氢气的量减少的原因是_____________。(用离子方程式表示)
(3)实验③反应速率加快的主要原因是___________。
II、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
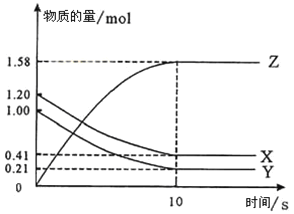
(1)写出该反应的化学方程式_______________。
(2)反应开始到10s,用X表示的反应速率是__________。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
a. 当X与Y的反应速率之比为1:1
b. 混合气体中X的质量分数保持不变
c. X、Y、Z的浓度之比为1:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com