
【题目】元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
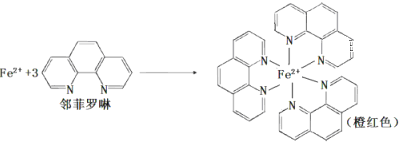
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
FeCl3+2NH2OHHCl= 4FeCl2+N2O↑+6HCl+H2O
① Fe3+在基态时,核外电子排布式_____;
② 羟胺中(NH2OH)采用sp3杂化的原子有______,三种元素电负性由大到小的顺序为______;
③ Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为____;
④N2O分子的空间构型为______(用文字描述)。
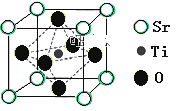
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可产生电流。钛酸锶晶体结构如图所示,则钛酸锶的化学式为_____。
【答案】 [Ar]3d5 N,O O>N>H 6 直线型 SrTiO3
【解析】试题(1)①Fe3+在基态时,核外共有23个电子,电子排布式为[Ar]3d5 ;② 根据价层电子对互斥理论,由VSEPR模型可知羟胺中(NH2OH)采用sp3杂化的原子有N,O; 三种元素电负性由大到小的顺序为O>N>H ;③ 配合物[FeA3] 2+中,Fe2+的配位数为6 ;④根据价层电子对互斥理论,N2O分子中,a=6,x=2,b=3,则中心原子上的孤对电子数=0,VSEPR模型可知N2O的空间构型为直线型;(2)由均摊法可知,在钛酸锶的晶胞中含有Sr的个数为8×1/8=1,含Ti的个数为1,含O的个数为6×1/2=3,所以化学式为SrTiO3 。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将一定物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
(1)判断:此反应此时_______(填“是”或“否”)达到了平衡状态。
(2)反应开始前容器中的A和B的物质的量之比为n(A):n(B)=_______。
(3)B的平均反应速率v(B)=________mol/(L·min)。
(4)x的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
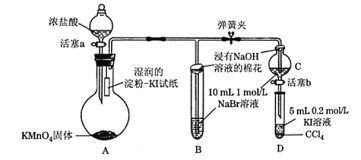
实验过程:
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_____。实验室在加热条件下制取该气体的离子方程式为_______。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为________。
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应的化学方程式为____________,以此说明C中_________,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为___________,发生反应的离子方程式为_________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的分子式均为 C8H8,下列说法正确的是
的分子式均为 C8H8,下列说法正确的是
A. a、b、c 均可与酸性高锰酸钾溶液反应
B. a、b、c 的二氯代物均只有 3 种
C. a 的同分异构体中除 b、c 外,还有可与溴水反应的物质
D. a、b、c 中只有 b、c 的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)X在元素周期表中的位置为____;画出X的简单离子结构示意图____。已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_______。
(2)四种元素简单离子的半径由大到小为______(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为____>____(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.实验室制乙炔时可用CuSO4除杂质气体
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替
D.乙炔的收集方法可用排空气法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 20gD2O与20g氖气所含有的电子数相同
B. 标准状况下,22.4L二氯甲烷的分子数约为NA
C. 常温常压下,100g 17%的双氧水溶液中含有氧原子总数为NA
D. 56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
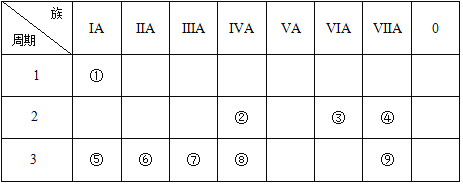
(1)表中用于半导体材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半径最小是__________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答)。
(5)②和③按原子数1:2形成的化合物的电子式为____,该晶体气化的过程中克服的微粒间作用力为______。
(6)③和⑧形成的化合物属于__________(填“离子化合物”或“共价化合物”),该晶体属于__________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的离子方程式为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com