
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )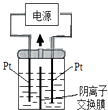
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-
B.电解结束后,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式:KI+3H2O=KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变。
【答案】D
【解析】A.左侧溶液变蓝色,生成I2 , 左侧电极为阳极,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH- , 发生还原反应,A不符合题意;
B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3- , B不符合题意;
C.左侧电极为阳极,电极反应为:2I--2e-=I2 , 同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH- , 故总的电极反应式为:KI+3H2O ![]() KIO3+3H2↑,C不符合题意;
KIO3+3H2↑,C不符合题意;
D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2 , 右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH- , 保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2 , 右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O ![]() 2KOH+I2+H2↑,D符合题意。答案选D。根据实验现象判断电极发生的反应类型,结合电解原理进行分析电解池中发生的反应即可.
2KOH+I2+H2↑,D符合题意。答案选D。根据实验现象判断电极发生的反应类型,结合电解原理进行分析电解池中发生的反应即可.


科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是( )
A.等体积的CO和N2B.质量相等、密度不等的N2和CO
C.原子数目相等的O3和N2D.质量相等的N2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A.含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol
B.已知热化学方程式:SO2(g)+ ![]() O2(g)
O2(g) ![]() SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.31kJ·mol-1 , 故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s) △H<-57.31kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )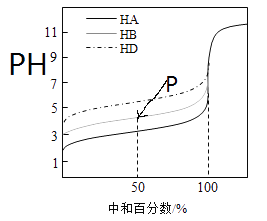
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A.氧化物:CO2 NO SO2 H2O
B.碱:NaOH KOH Ba(OH)2 Na2CO3
C.铵盐:NH4Cl NH4NO3 (NH4)2SO4 NH3H2O
D.碱性氧化物:Na2O CaO Mn2O7 MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法不正确的是( )
2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法不正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 012 | 011 | 010 | 010 |
A.反应前2min的平均速率v(Z)=2.0×10-5mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.该温度下此反应的平衡常数:K=1.44
D.保持其他条件不变,起始时向容器充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)=0.024mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下: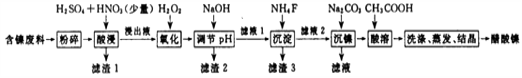
相关离子生成氢氧化物的pH和相关物质的溶解性如下表: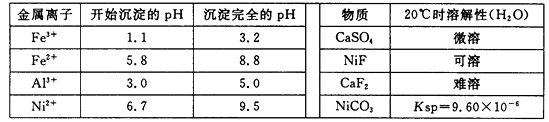
(1)调节pH步骤中,溶液pH的调节范围是。
(2)滤渣1和滤渣3主要成分的化学式分别是、。
(3)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式。
(4)沉镍前c(Ni2+)=2.0 mol· L-1 , 欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为g。(保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )
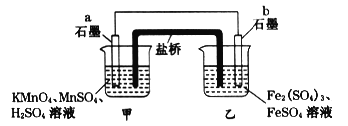
A. a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. b电极上发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com