
 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
分析 I.(1)根据Q=△H=m•c•△T计算反应热,结合中和热定义:在稀溶液中酸与碱发生中和反应生成1mol水放出的热量解答;
( 2 )根据热化学方程式中系数和焓变的关系来书写热化学方程式,注意中和热为生成1mol水放出热量;
Ⅱ.(1)H2C2O4与酸性KMnO4溶液发生氧化还原反应,H2C2O4被氧化成CO2,KMnO4被还原成Mn2+,根据电子得失守恒、质量守恒和电荷守恒来配平;
(2)KMnO4具有强氧化性,会腐蚀橡胶管;滴定终点时溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
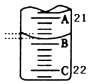
(3)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度21,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(4)根据所用过程判断不当操作对相关物理量的影响判断;
(5)根据化学方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算H2C2O4的浓度.
解答 解:I.(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应,二者反应生成水物质的量为0.02mol,放出的热量Q=△H=m•c•△T,则反应热为:△H=-4.18J/(g•℃)×100mL×1g/cm3(T2-T1),在稀溶液中酸与碱发生中和反应生成1mol水放出的热量为中和热,则中和热的计算公式为:△H=-4.18J/(g•℃)×100mL×1g/cm3(T2-T1)÷0.02mol,即△H=-20.9(T2-T1);
故答案为:-20.9(T2-T1);
(2)根据稀1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l),△H=-114.6kJ/mol,
表示该反应中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l),△H=-57.3kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l),△H=-57.3kJ/mol;
Ⅱ(1)H2C2O4与酸性KMnO4溶液发生氧化还原反应,H2C2O4被氧化成CO2,KMnO4被还原成Mn2+,反应的离子方程式为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O;
故答案为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O;
(2)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装;KMnO4溶液呈紫色,草酸反应完毕,当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
故答案为:酸式;当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;
(3)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为21,A和B之间是四个小格,所以相差0.40mL,则B是21.40mL;
故答案为:21.40;
(4)A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积,液面偏高,读数偏小,导致KMnO4体积偏小,故A错误;
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,导致KMnO4体积偏小,故B错误;
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗,KMnO4浓度偏小,导致KMnO4体积偏大,故C正确;
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,润洗锥形瓶导致草酸的物质的量偏大,导致KMnO4体积偏大,故D正确;
故选:BD;
(5)从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,应舍弃,则消耗标准液的体积为:$\frac{24.02+23.98}{2}$=24mL;
依据滴定原理:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O 可知:
6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O
2 5
c×24mL C×VmL
2:c×24mL=5:C×VmL 解得C=$\frac{60c}{V}$mol/L;
故答案为:$\frac{60c}{V}$mol/L.
点评 本题考查了热化学方程式的书写,中和热的测定,以物质含量为背景考查氧化还原滴定与计算,难度中等,注意实验原理的掌握,滴定管结构与使用等,注意中和热的概念.


科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 滴管不能交叉使用 | |
| C. | 气体实验装置在实验前进行气密性检查 | |
| D. | 可燃性气体的验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 仅② | C. | ②④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝比铁化学性质活泼 | |
| B. | 铝表面有一层致密氧化膜起保护作用 | |
| C. | 铝性质太活泼已经全部被氧化成了氧化铝 | |
| D. | 铁有可能只失去二个电子而铝失三个电子,从而比铝更容易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 一学生用pH试纸测得某氯水的pH为2 | |
| C. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| D. | 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com