
����Ŀ����Ȼ����H���п���������������ԣ���ͨ������·�ߺϳɡ�

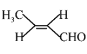
��֪: (
(![]() ��)
��)
�ش��������⣺
(1)A����״ͬ���칹��ɷ���������Ӧ��д����Щͬ���칹�����п��ܵĽṹ��__________��
(2)�ں˴Ź��������У�������B��________�����շ塣
(3)������X�Ľṹ��ʽΪ___________��
(4)D��E�ķ�Ӧ����Ϊ___________��
(5)F�ķ���ʽΪ_______��G���������ŵ�����Ϊ___________��
(6)������H��������̼ԭ�ӵ���ĿΪ_____���������ʲ�����H������Ӧ����_______(�����)��
a.CHCl3 b.NaOH��Һ c.����KMnO4��Һ d.����Na
(7)�� ��
��![]() Ϊԭ�ϣ��ϳ�
Ϊԭ�ϣ��ϳ�![]() ��д��·������ͼ(���Լ��Ͳ�����2��̼���л��Լ���ѡ)_______________��
��д��·������ͼ(���Լ��Ͳ�����2��̼���л��Լ���ѡ)_______________��
���𰸡�![]() ��
��![]() ��
�� ��
��![]() 4
4 ![]() �ӳɷ�Ӧ
�ӳɷ�Ӧ ![]() �ʻ������� 1 a
�ʻ������� 1 a 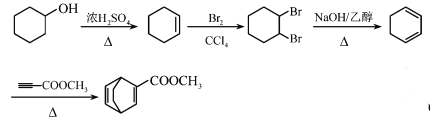
��������
����������Ϣ����ͬ���칹��ṹ��д�����ܵ�ͬ���칹�壻�����л���ṹ�����л�����Hԭ�ӵĻ�ѧ���������ݷ�Ӧǰ���л���ṹ�ͷ���ʽ�ƶϷ�Ӧǰ��Ӧ�Ľṹ��������֪�����ж��л���Ӧ���ͣ������л���ṹ�ж��л�����ܷ����ķ�Ӧ��������Ŀ�����ĺϳ����̺���֪����ѡ����ʵķ�Ӧ·���Ʊ�Ŀ�����ʡ�
(1) A����״ͬ���칹��ɷ���������Ӧ˵����ͬ���칹���к���ȩ�����ʿ��ܵĽṹΪ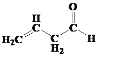 ��
��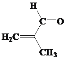 ��
��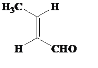 ��
��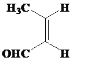 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
�� ��
��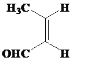 ��
��
(2)����B�Ľṹ���л���B�к���4�ֲ�ͬ��ѧ������Hԭ�ӣ����ں˴Ź�����������4��壻�ʴ�Ϊ��4��
(3)�����л���C���л���D�Ľṹ���л���C���л���X����������Ӧ�����л���D�����л���D�Ľṹ��ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4) D��EΪ��֪�����ķ�Ӧ����Ӧ����Ϊ�ӳɷ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��
(5)����F�Ľṹ��ʽ���л���F�ķ���ʽΪC13H12O3���л���G�к��еĹ������������������ʻ����ʴ�Ϊ��C13H12O3���������ʻ���
(6)�����л���H�Ľṹ���л���H�к���1������̼ԭ�ӣ�Ϊ���½����ǻ����ڵ�̼ԭ�ӣ�
�л���H�к����ǻ������������Na������Ӧ���л���H�к���̼̼˫�������������Ը��������Һ��Ӧ���л���H�к������������Ա�NaOHˮ�⣻�л���H�в�����CHCl3��Ӧ�Ļ��ţ��ʲ���CHCl3��Ӧ����ѡ��a���ʴ�Ϊ��1��a��
(7)����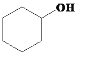 ��
��![]() ��Ӧ�Ƶ�
��Ӧ�Ƶ�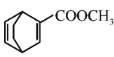 �����Ƚ���������ˮ�û���ϩ��������ϩ��
�����Ƚ���������ˮ�û���ϩ��������ϩ�������巢���ӳɷ�Ӧ�ٷ�����ȥ��Ӧ�Ƶ�1,3-������ϩ��
![]() ������1,3-������ϩ��
������1,3-������ϩ��![]() ������֪�����ķ�Ӧ�Ƶ�
������֪�����ķ�Ӧ�Ƶ�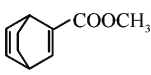 ����Ӧ�ľ�������Ϊ��
����Ӧ�ľ�������Ϊ��
![]()

![]()
![]()

 ���ʴ�Ϊ��
���ʴ�Ϊ��
![]()

![]()

![]()


 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����
A.1mol���ǻ���1mol������������������������Ϊ9NA
B.���³�ѹ�£�18g H2O���е�ԭ������Ϊ3NA
C.��״���£�11.2LCH3CH2OH�к��з��ӵ���ĿΪ0.5NA
D.���³�ѹ�£�2.24LCO��CO2��������к��е�̼ԭ����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A.CaCO3��ϡ���ᷴӦ��![]()
B.FeSO4��Һ����ˮ��Ӧ��![]()
C.NaOH��Һ�����H2C2O4��Һ��Ӧ��![]()
D.C6H5ONa��Һ��ͨ������CO2: ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ�����ʹ����ȷ���ǣ� ��
A.�ڻ�̬�����ԭ���У�p������ӵ�����һ������s������ӵ�����
B.Feԭ�ӵ���Χ�����Ų�ͼΪ![]()
C.���ĵ縺�Աȵ�����Ԫ�صĵ�һ�����ܱȵ�Ԫ�صĵ�һ�����ܴ�
D.ͭԭ�ӵ���Χ�����Ų�ʽΪ3d94s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨCuSO4��Һ��Ũ�ȣ��ס�����ͬѧ����������������ش��������⣺
��.����
ʵ��ԭ����![]()
ʵ�鲽�裺

(1)�ж�![]() ������ȫ�IJ���Ϊ____________��
������ȫ�IJ���Ϊ____________��
(2)������жϳ����Ƿ�ϴ����ѡ�õ��Լ�Ϊ_____________��
(3)���������ʱʢװ��Ʒ����������Ϊ__________��
(4)��������Ϊwg����c(CuSO4)=________molL-1��
(5)������ٴ��ձ���ת�Ƴ���ʱδϴ���ձ�������c(CuSO4)_________(����ƫ��������ƫ����������Ӱ����)��
��.�ҷ���
ʵ��ԭ����![]() ��
��![]()

ʵ�鲽��:
�ٰ���ͼ��װװ��(�г�������ȥ)
������
��������A��B��C��D��E���м���ͼʾ���Լ�
�ܵ���D��E����Һ����ƽ��ʹD��Һ�汣����0���Ե���0�̶�λ�ã���������¼��
�ݽ�CuSO4��Һ����A�н��裬��Ӧ��ɺ��ٵμ�ϡ��������ϵ�������������
����ϵ�ָ������£��ƶ�E�ܣ�����D��E����Һ����ƽ����������¼
�ߴ�������
(6)�����Ϊ___________��
(7)������豣֤��ϵ�ָ������µ�ԭ����________(�����)��
a.��Ӧ�����¶�Ӱ�� b.�����ܶ����¶�Ӱ�� c.��Ӧ�������¶�Ӱ��
(8)Zn������Ϊag�������H2���ΪbmL����֪ʵ��������![]() ����c(CuSO4)______molL-1(�г��������ʽ)��
����c(CuSO4)______molL-1(�г��������ʽ)��
(9)�������E��Һ�����D�ܣ�δ��Һ�漴����������c(CuSO4)________(����ƫ��������ƫ����������Ӱ����)��
(10)�Ƿ�����ͬ����װ�úͷ����ⶨMgSO4��Һ��Ũ�ȣ�_________(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������Ԫ�ص�ԭ�ӽṹʾ��ͼ��
���˵����Ϊ13��Ԫ�أ�__________��
��ijԪ��ԭ�ӵ��������������ڴ�����������__________________ ��
��L ���������M�������2����Ԫ�أ� ___________________ ��
��ijͬλ��ԭ�Ӻ���û�����ӵ�Ԫ�أ� ___________________ ��
��2��д��1��18��Ԫ���з�������������ԭ�����������������źͽṹʾ��ͼ��
��ijԪ��ԭ��L���ϵĵ�����ΪK���3���� __________________ ��
��ijԪ��ԭ��L���ϵĵ�����ΪK���һ�룺 _________________ ��
���õ�2�����Ӻ����������ԭ�ӵĵ���������ͬ�����ӣ� ___________________ ��
��ijԪ��ԭ�ӵ��������������ڴ�����������2���� ___________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ�������������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⣺

��1��д����ȡ���������Ļ�ѧ��Ӧ����ʽ ��
��2��Ũ����������ǣ� ��
��3������̼������Һ����Ҫ������___ ��
��4��װ����ͨ�����ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ����________________��
��5����Ҫ���Ƶõ������������������Ӧ���õ�ʵ�������__________��
��6���������������ķ�Ӧ�ǿ��淴Ӧ����Ӧ�ﲻ����ȫ����������Ӧһ��ʱ��ʹﵽ�˸÷�Ӧ���ȣ�Ҳ���ﵽ��ѧƽ��״̬������������˵���Ҵ��������������Ӧ�Ѵﵽ��ѧƽ��״̬����(�����) ��
����λʱ�������1mol����������ͬʱ����1molˮ
����λʱ�������1mol����������ͬʱ����1mol����
����λʱ�������1mol�Ҵ���ͬʱ����1mol����
������Ӧ���������淴Ӧ���������
��������и����ʵ�Ũ�Ȳ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������У���HCl����N2����NH3����Na2O2����C2H4����NaOH����Ar
��1��ֻ���ڼ��Լ��ķ�����___��ֻ�ɷǼ��Լ����ɵķǼ��Է�����__��(����ţ���ͬ)��
��2��CO32��������ԭ�ӵ��ӻ����������__�����Ŀռ乹����__��
��3����K3[Fe��CN��6]������������__��������__�������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
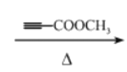
����Ŀ���������ֻ��������£�
�ף�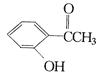 �ң�
�ң�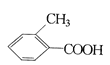 ����
����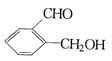
��ֱ�д������ס��ҡ������ֻ�����ķ�����ָ����ѡ�Լ�����Ҫ������ķ�����__________�����ҵķ�����_____________ ��������ķ���_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com