
【题目】氮化硼![]() 广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为
广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() 等)为原料,制备氮化硼的一种工艺流程如下:
等)为原料,制备氮化硼的一种工艺流程如下:
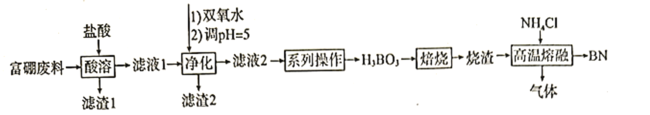
已知:硼酸溶于水和乙醇,在水中的溶解度如下
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度( | 2.77 | 4.78 | 8.90 | 14.89 | 23.54 | 39.60 |
回答下列问题:
(1)“酸溶”时需控制适当温度,温度不能过高的原因为____________________________;除控制适当温度外,可加快“酸溶”速率的措施还有__________________(答出一点即可)。
(2)“净化”时第一步反应的化学方程式为__________________;第二步调![]() 的目的为_______________;滤液2中
的目的为_______________;滤液2中![]() _______________(已知
_______________(已知![]() )
)
(3)“系列操作”中,洗涤结晶出来的硼酸的操作为__________________________。
(4)“高温熔融”过程中生成的气体为两种氢化物,则主要反应的化学方程式为__________________________;生成的气体用水吸收后可返回__________________________工序循环利用。
【答案】盐酸挥发使产率降低 搅拌、适当增大盐酸浓度等 2FeCl2+H2O2+2HCl=2FeCl3+2H2O 将Fe3+和Al3+完全转化为Al(OH)3、Fe(OH)3过滤除掉,而H3BO3保留在滤液中 1.3![]() 10-6mol/L 向过滤器中用玻璃棒引流加入0℃水至没过硼酸晶体,水自然流下,重复2~3次 B2O3+2NH4Cl
10-6mol/L 向过滤器中用玻璃棒引流加入0℃水至没过硼酸晶体,水自然流下,重复2~3次 B2O3+2NH4Cl ![]() 2BN+2HCl↑+3H2O 酸溶
2BN+2HCl↑+3H2O 酸溶
【解析】
富硼废料(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() 等)为原料,加入盐酸酸溶后得到滤渣1为
等)为原料,加入盐酸酸溶后得到滤渣1为![]() ,滤液1加入双氧水调节pH=5净化得到滤渣2为Al(OH)3、Fe(OH)3,过滤后得到滤液2通过一系列操作得到硼酸,硼酸焙烧后得到的烧渣主要为B2O3,与氯化铵高温熔融后制备氮化硼,同时生成氯化氢气体和水,据此分析。
,滤液1加入双氧水调节pH=5净化得到滤渣2为Al(OH)3、Fe(OH)3,过滤后得到滤液2通过一系列操作得到硼酸,硼酸焙烧后得到的烧渣主要为B2O3,与氯化铵高温熔融后制备氮化硼,同时生成氯化氢气体和水,据此分析。
(1)盐酸易挥发,故用盐酸进行“酸溶”时,温度过高,会导致盐酸挥发使产率降低。除控制适当温度外,可加快“酸溶”速率的措施可搅拌、适当增大盐酸浓度等;
(2)“净化”时第一步反应的目的是将FeCl2氧化为FeCl3,反应的化学方程式为2FeCl2+H2O2+2HCl=2FeCl3+2H2O;第二步调pH=5可将Fe3+和Al3+完全转化为Al(OH)3、Fe(OH)3过滤除掉,而H3BO3保留在滤液中;pH=5时,溶液中的c(OH-)=1![]() 10-9 mol/L,c(Al3+ )=
10-9 mol/L,c(Al3+ )= =
=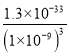 =1.3
=1.3![]() 10-6mol/L;
10-6mol/L;
(3)由信息知,硼酸冷水中溶解度低,为减少溶解损失,方法为向过滤器中用玻璃棒引流加入0℃水至没过硼酸晶体,水自然流下,重复2~3次;
(4) 硼酸焙烧后得到的烧渣主要为B2O3,“高温熔融”过程中B2O3与氯化铵反应生成的气体为HCl和水蒸气,则主要反应的化学方程式为B2O3+2NH4Cl ![]() 2BN+2HCl↑+3H2O;生成的气体用水回收后得盐酸,可返回到“酸溶”工序循环利用。
2BN+2HCl↑+3H2O;生成的气体用水回收后得盐酸,可返回到“酸溶”工序循环利用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为N2O4![]() 2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
(2) 20 s时四氧化二氮的浓度c1=________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为________mol/(L·s)。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为m kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025m kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() 是可逆反应。设计如图装置(
是可逆反应。设计如图装置(![]() 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
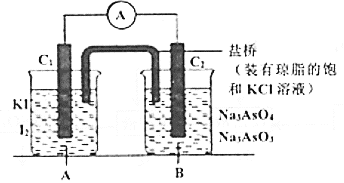
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入![]() 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中![]() 棒上发生的反应为_________;
棒上发生的反应为_________;
②过程中![]() 棒上发生的反应为___________。
棒上发生的反应为___________。
(2)操作②过程中,盐桥中的![]() 移向_________烧杯溶液(填“A”或“B”)。
移向_________烧杯溶液(填“A”或“B”)。
资料:![]() 。向
。向![]() 一定浓度的
一定浓度的![]() 溶液中加入
溶液中加入![]() 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
微粒 |
|
|
|
浓度 |
|
| a |
(3)a=________________。该平衡体系中除了含有![]() 和
和![]() 外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:![]()
反应:![]()
则![]() ______________
______________![]()
(5)已知:25℃时,![]() 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用![]() 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量![]() 仍然是安全的,
仍然是安全的,![]() 不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量
不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量![]() ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的![]() 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中![]() 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的![]() 浓度为
浓度为![]() ,应服用的
,应服用的![]() 溶液的最低浓度为_______
溶液的最低浓度为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A单质是密度最小的气体。B是周期表已知元素中非金属性最强的元素,且和C属同一主族。D、E、F属同一周期,D、F为主族元素,又知E、F的原子序数分别是29、33。D跟B可形成离子化合物,其晶胞结构如图:

(1)比C元素质子数少1的原子的价层电子的轨道表示式为__________。
(2)E元素在周期表中第_____周期,第_____族的元素,它的+2价离子的电子排布式为________。写出E的单质与稀硝酸反应的离子方程式___________。
(3)F元素的名称是_____。与F同一主族的第二、三周期元素与A形成的化合物沸点的高低为___________>__________(用化学式表示),判断的理由____________。
(4)写出D跟A形成的化合物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钠元素,只需经过物理变化就可以得到金属钠
B.海水蒸发制得粗盐,经提纯后再电解盐溶液可以得到金属钠
C.从海水中提纯到的食盐,电解饱和食盐水产生的产物可以制得“84”消毒液(NaClO)
D.可以通过物理方法直接从海水中提取溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1
4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH=1 160 kJ·mol1
2N2(g)+CO2(g)+2H2O(g) ΔH=1 160 kJ·mol1
下列说法不正确的是
A. 由反应①可推知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
B. 等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C. 若用标准状况下4.48 L CH4还原NO2至N2,则放出的热量为173.4 kJ
D. 若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com