
【题目】用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1
4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH=1 160 kJ·mol1
2N2(g)+CO2(g)+2H2O(g) ΔH=1 160 kJ·mol1
下列说法不正确的是
A. 由反应①可推知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
B. 等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C. 若用标准状况下4.48 L CH4还原NO2至N2,则放出的热量为173.4 kJ
D. 若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
【答案】B
【解析】
A.由气态水变为液态,放出热量;
B.根据C元素的化合价变化来计算转移的电子;
C.根据盖斯定律及物质的量与反应热的数值关系来解答;
D. (①+②)![]() 2可以知道CH4(g)+2NO2(g)
2可以知道CH4(g)+2NO2(g)![]() CO2(g) + 2H2O(g) +N2(g),1molCH4 反应转移8mol电子。
CO2(g) + 2H2O(g) +N2(g),1molCH4 反应转移8mol电子。
A.由CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1,水由气态变为液态,放出热量,则CH4(g)+4NO2(g)
4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1,水由气态变为液态,放出热量,则CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
所以A选项是正确的;
B.两个反应中,C元素的化合价均由-4价升高到+4价,则等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同,故B错误;
C. (①+②)![]() 2可以知道CH4(g)+2NO2(g)
2可以知道CH4(g)+2NO2(g)![]() CO2(g) + 2H2O(g) +N2(g) ΔH=867 kJ·mol1,标准状况下4.48 L CH4其物质的量为0.2mol,则放出的热量为0.2mol
CO2(g) + 2H2O(g) +N2(g) ΔH=867 kJ·mol1,标准状况下4.48 L CH4其物质的量为0.2mol,则放出的热量为0.2mol![]() 867kJ/mol=173.4kJ,所以C选项是正确的;
867kJ/mol=173.4kJ,所以C选项是正确的;
D. CH4(g)+2NO2(g)![]() CO2(g) + 2H2O(g) +N2(g),1molCH4 反应转移8mol电子,则用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为0.2mol
CO2(g) + 2H2O(g) +N2(g),1molCH4 反应转移8mol电子,则用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为0.2mol![]() 8=1.6mol,所以D选项是正确的。
8=1.6mol,所以D选项是正确的。
故答案选B。


科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(1)该混合溶液中Ba(OH)2的物质的量浓度=_____________。
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是
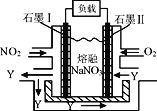
A. 石墨电极Ⅱ为电池负极
B. 电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动
C. 石墨I电极发生的电极反应为NO2+NO3--e-=N2O5
D. 每消耗1 mol NO2转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 56 g Fe 与1mol Cl2充分反应,转移的电子数为3NA
B. 分子数为 0.1NA的CH4和NH3混合气体,含有的共用电子对数为0.4NA
C. 25℃时,1L pH=12的Ba(OH)2溶液中含有0.02NA 的OH-
D. 常温常压下,22 g D3O+中含有10NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(仅含三种元素,摩尔质量为198g·mol-1)具有高效的消毒作用,是一种新型非氮高效消毒剂。为探究化合物A的组成与性质,设计并完成以下实验:取3. 96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL 0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g。将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐。
(1)化合物A所含有的元素:_______________(用元素符号表示)。
(2)化合物A与H2O反应的离子方程式:__________________。
(3)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?________,其理由是___________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com