
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
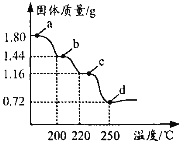
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
【答案】BC
【解析】
A项、1.80gFeC2O42H2O的物质的量为![]() =0.01mol,由图可知,减少的质量为水的质量,减少水的物质的量为
=0.01mol,由图可知,减少的质量为水的质量,减少水的物质的量为![]() =0.02mol,说明结晶水已全部失去,b点的固体成份为FeC2O4,故A错误;
=0.02mol,说明结晶水已全部失去,b点的固体成份为FeC2O4,故A错误;
B项、由铁原子个数守恒,可知1.16g固体中铁的质量为0.56g,阴离子的质量为(1.16—0.56)g=0.60g,损失的质量为(1.44—1.16)g=0.28g,则b→c的反应FeC2O4为受热分解生成FeCO3和CO,故B正确;
C项、b→c的反应中生成一氧化碳的物质的量为![]() =0.01mol,c→d的反应中生成一氧化碳的物质的量为
=0.01mol,c→d的反应中生成一氧化碳的物质的量为![]() =0.01mol,故C正确;
=0.01mol,故C正确;
D项、加热至250℃以上,固体质量略有增加,可能是因为FeO与空气中氧气反应生成了Fe3O4或Fe2O3,故D错误;
故选BC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是黄绿色易溶于水的气体,熔点-59℃、沸点11℃,但其浓度过高时易发生分解,因此常将其制成NaClO2固体便于运输和贮存。回答下列问题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
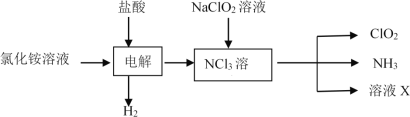
①电解时发生反应方程式为__________。
②溶液X中大量存在的溶质有__________(填化学式)。
③除去ClO2中的NH3可选用的试剂是_________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(2)实验室中用过氧化氢法将ClO2制备成NaClO2固体,其实验装置如图所示。
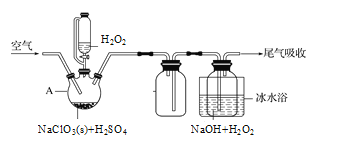
①A中发生的反应为2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O,仪器A的名称是_______。
②写出制备NaClO2固体的化学方程式:__________。冰水浴冷却的目的是________。
③空气流速过快或过慢,均会降低NaClO2的产率,其原因是______________。
④为了测定NaClO2粗品的纯度,取上述粗产品10.0g溶于水配成1L溶液,取出10mL,溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol·L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL,试计算NaClO2粗品的纯度_______。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目。
(1)方案Ⅰ:有人提出将大小相等的铁片和铜片同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________________________。
(2)方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式______________________________________。
(3)方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):_________________________________________________;用离子方程式表示其反应原理:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
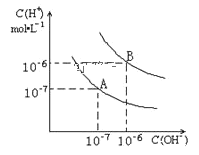
(1)25℃时,水的电离平衡曲线应为_________请说明理由_________
(2)95℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为_________
(3)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO的浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为______;反应
H2(g)+I2(g)的平衡常数K2为______;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3为________。
HI(g)的平衡常数K3为________。
(II)在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)该反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L1,c(H2)=1.5mol·L1,c(CO)=1mol·L1,c(H2O)=3mol·L1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.向0.1mol·L-1的CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
B.相同浓度的CH3COONa和HCOONa的混合溶液中:c(Na+)>c(HCOO-)>c(CH3COO-)>c(OH-)
C.c(NH![]() )相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
)相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
D.0.1mol·L-1的CH3COOH溶液和0.05mol·L-1的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )
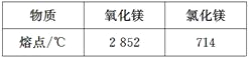
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com