
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
【答案】B
【解析】
A.弱电解质的电离过程是吸热过程,则HCNH++CN-的ΔS>0、ΔH>0,故A正确;
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,完全中和时生成NaCN,溶液显碱性,则应选择酚酞做指示剂,故B错误;
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,溶液中溶质HCN和NaCN等物质的量,因CN-的水解常数Kh=![]() =
=![]() >Ka,说明溶液中CN-的水解程度大于HCN的电离程度,即该溶液呈碱性,故C正确;
>Ka,说明溶液中CN-的水解程度大于HCN的电离程度,即该溶液呈碱性,故C正确;
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,溶液中溶质HCN和NaCN等物质的量,溶液中的电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(CN-),物料守恒式为2c(Na+)=c(HCN)+c(CN-),则2c(H+)+c(HCN)=2c(OH-)+c(CN-),故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa 下,11.4 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出 551.76 kJ 能量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
B.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
C.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生:![]() ,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
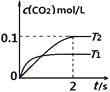
(1)T1____________T2 , 其理由是____________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=____________
(3)下列叙述中能判断该反应达平衡状态的是____________
A. 平衡体系中气体压强不再改变 B. 平衡体系中气体密度不再改变
C. c(CO2):c(N2)=2:1 D. V正(CO):V逆(N2)=2:1
(4)若容器恒容,绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(5)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=_________,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2, 则反应向_________(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ_________Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为(请写出两条)_________________ __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。

己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解。
(1)反应I的离子方程式为____;反应中需同时鼓入空气的主要目的是____ °
(2)“合成”过程中的氧化剂是______。
(3)蒸发时,需要减压的目的是_____。
(4)“冷却结晶”后获得NaClO,粗产品的操作是_____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
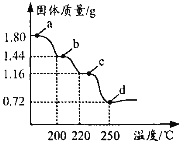
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )

A.用图1装置可以实现化学能持续转化为电能
B.放出图2装置中全部液体,体积为42.00 mL
C.用图3装置可以制备少量氢氧化铁胶体
D.用图4装置可以检验乙醇脱水后有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)存在下列转化关系,下列说法正确的是
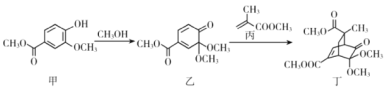
A.丙的分子式为C5H10O2B.乙→丁的反应类型为加成反应
C.乙、丁中的官能团种类均为3种D.甲的同分异构体中含有苯环且取代基与甲完全相同有9种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com