
【题目】香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)存在下列转化关系,下列说法正确的是
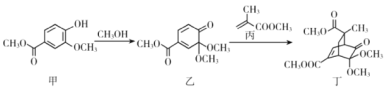
A.丙的分子式为C5H10O2B.乙→丁的反应类型为加成反应
C.乙、丁中的官能团种类均为3种D.甲的同分异构体中含有苯环且取代基与甲完全相同有9种
【答案】BD
【解析】
A.根据丙的结构简式可知丙的分子式为C5H8O2,故A错误;
B.乙生成丁的过程中乙中的共轭双键打开发生1,4加成,丙中碳碳双键打开发生加成,形成环状结构,所以该反应属于加成反应,故B正确;
C.乙中有碳碳双键、醚键、酮基、酯基共4种官能团,丁中有醚键、酮基、酯基、碳碳双键共4种官能团,故C错误;
D.甲的苯环上有三个不同的官能团,当其中两个官能团位于邻位或间位时,苯环剩余4个氢原子均不同,所以此时另一个取代基分别有4种位置,当其中两个官能团位于对位时,苯环上有2种环境的氢,所以另一个取代基有2种位置,则包括甲在内的所有同分异构体共有4+4+2=10种,除去甲还有9种,故D正确;
故答案为BD。


科目:高中化学 来源: 题型:
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.向0.1mol·L-1的CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
B.相同浓度的CH3COONa和HCOONa的混合溶液中:c(Na+)>c(HCOO-)>c(CH3COO-)>c(OH-)
C.c(NH![]() )相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
)相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
D.0.1mol·L-1的CH3COOH溶液和0.05mol·L-1的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为Mg/mol,现有该气体mg, 用NA表示阿伏加德罗常数,求下列量:
①该气体的物质的量为______________mol;
②该气体在标准状况下的体积为_________________L;
③该气体在标准状况下的密度为_________________g/L;
④该气体一个分子的质量为_________________g;
⑤该气体m g完全溶解于水(气体与水不反应),得到100mL溶液,所得溶液的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g-OH中含有的电子数为10NA
B.25°C时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C.1L1molL-1CH3COONH4溶液中CH3COO-与NH4+数目均为NA
D.含0.5mol晶胞(下图)的Cu2O晶体中Cu2+的数目为2NA

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取6根铁钉,6支干净的试管及其他材料,如图所示。
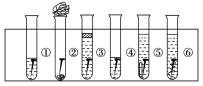
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____(填试管序号);在电化学腐蚀中,负极反应是____,正极反应是______。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是____________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥分析下列氧化还原反应,并按要求填空。2Al+3H2SO4 =Al2(SO4)3+3H2↑_______
(1)氧化剂:________,氧化产物:________;
(2)标准状况下,生成3.36L H2,参加反应的Al的质量是_______,转移的电子的物质的量为_____,若溶液中H2SO4的物质的量浓度为1.5 mol/L,则恰好完全反应需加入的H2SO4溶液的体积_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com