
【题目】(I)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为______;反应
H2(g)+I2(g)的平衡常数K2为______;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3为________。
HI(g)的平衡常数K3为________。
(II)在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)该反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L1,c(H2)=1.5mol·L1,c(CO)=1mol·L1,c(H2O)=3mol·L1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
【答案】![]() 7
7 ![]() 吸热 830 逆向
吸热 830 逆向
【解析】
(I)先写出三个反应的化学平衡常数表达式,然后对比,找出平衡常数的关系,从而可得K2、K3的数值;
(II)(1)根据平衡常数的含义书写该反应的平衡常数表达式;
(2)根据温度对平衡常数的影响,结合温度与平衡移动原理的关系判断;
(3)将该平衡浓度关系变形,计算平衡常数的值,再与表格数据对照,得到反应温度;
(4)将相应物质的浓度带入浓度商式中,计算其数值,再与该温度下的平衡常数进行比较,判断反应进行的方向。
(I)反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,K1=
2HI(g)的平衡常数K1为49,K1=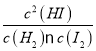 =49,该温度下反应2HI(g)
=49,该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2=
H2(g)+I2(g)的平衡常数K2=![]() =
=![]() ;反应
;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3=
HI(g)的平衡常数K3=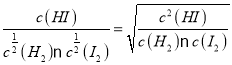 =
=![]() =7;
=7;
(II)(1)由于化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)的化学平衡常数K=
CO(g)+H2O(g)的化学平衡常数K=![]() ;
;
(2)根据表格数据可知:温度升高,化学平衡常数增大,说明升高温度,平衡正向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应;
(3)将该平衡浓度关系c(CO2)·c(H2)=c(CO)·c(H2O)变形,![]() = 1,可得其平衡常数的值为1,由表格中温度与化学平衡常数的数据关系可知反应温度是830℃;
= 1,可得其平衡常数的值为1,由表格中温度与化学平衡常数的数据关系可知反应温度是830℃;
(4)该反应在某时刻的浓度商数值为Qc=![]() =1,数值大于800℃的化学平衡常数0.9,说明生成物的浓度相对较大,因此下一时刻反应逆向进行。
=1,数值大于800℃的化学平衡常数0.9,说明生成物的浓度相对较大,因此下一时刻反应逆向进行。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】目前锂电池的应用日益广泛,而废旧锂电池的回收利用是十分重要的课题。回收利用废旧锂电池的流程如下:

已知:①锂电池废料的主要成分是LiCoO2、铝、炭黑及其他杂质。
②“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
请回答:
(1)步骤Ⅰ中铝溶解的离子方程式为_____;
步骤Ⅲ中LiCoO2固体溶解的化学方程式为_______;
(2)关于步骤Ⅱ,下列实验操作或说法合理的是_________
A.灼烧前,灼烧使用的蒸发皿洗净后不需要擦干,然后加入固体X进行灼烧
B.灼烧时需要用玻璃棒不断搅拌
C.灼烧至恒重是指前后两次称量所得质量之差不得超过一定的允许误差,这个允许误差一定为0.01g
D.在电解熔融的Al2O3制备金属铝时,通常需加入冰晶石(NaAlF6)以增强其导电性
(3)步骤Ⅳ中除杂时可加入氨水调节溶液的pH,实验表明溶液A中各种金属离子的沉淀率随pH的变化如下图所示,则步骤Ⅳ中可除去的杂质离子是_________。
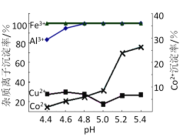
(4)步骤Ⅴ可采用酸碱滴定法测定碳酸锂的纯度。滴定原理如下:碳酸锂能够与盐酸反应生成氯化锂和二氧化碳,在碳酸锂未完全反应时,溶液保持中性(pH=7)。反应完全后,随着盐酸的继续滴入,溶液pH下降,以甲基红—溴甲粉绿为指示剂,用盐酸标准液滴定试样,用消耗盐酸标准滴定溶液的量来计算碳酸锂的含量。
①配制约0.30molL-1盐酸溶液不需要用到的仪器有________(填编号)
a.量筒b.电子天平c.漏斗d.烧杯e.容量瓶f.玻璃棒g.胶头滴管
②用0.3000molL-1盐酸标准溶液滴定,其中正确操作步骤的顺序为________
a.加入0.1-0.2mL甲基红—溴甲粉绿作指示剂;
b.煮沸去除CO2,再冷却到室温;
c.将试样置于250mL锥形瓶中,加入20mL水溶解;
d.用盐酸标准液滴定至试液由绿色变成酒红色;
e.继续滴定至酒红色(滴定突跃区域)即为终点
③碳酸锂的纯度可用下式计算:ω=![]() ,其中:ω—碳酸锂试样的纯度;m—碳酸锂试样的质量(g);c—盐酸标准液的浓度(molL-1)V1—试样滴定时消耗盐酸的体积(mL);V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL),0.03694—与1.00mL标准盐酸(c=1.000molL-1)相当的碳酸锂的质量(g)。
,其中:ω—碳酸锂试样的纯度;m—碳酸锂试样的质量(g);c—盐酸标准液的浓度(molL-1)V1—试样滴定时消耗盐酸的体积(mL);V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL),0.03694—与1.00mL标准盐酸(c=1.000molL-1)相当的碳酸锂的质量(g)。
滴定空白溶液的目的是_________,上述滴定操作中,缺少“煮沸去除CO2,再冷却到室温”这个步骤,测定结果将_________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生:![]() ,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
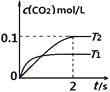
(1)T1____________T2 , 其理由是____________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=____________
(3)下列叙述中能判断该反应达平衡状态的是____________
A. 平衡体系中气体压强不再改变 B. 平衡体系中气体密度不再改变
C. c(CO2):c(N2)=2:1 D. V正(CO):V逆(N2)=2:1
(4)若容器恒容,绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(5)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=_________,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2, 则反应向_________(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ_________Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为(请写出两条)_________________ __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
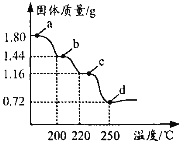
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的相关化学用语表示正确的是( )
A.质子数为16,中子数为16的硫原子:![]() S
S
B.硫化钠的电子式:![]()
C.二硫化碳分子的比例模型:![]()
D.NaHSO3电离方程式:NaHSO3=Na++H++SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )

A.用图1装置可以实现化学能持续转化为电能
B.放出图2装置中全部液体,体积为42.00 mL
C.用图3装置可以制备少量氢氧化铁胶体
D.用图4装置可以检验乙醇脱水后有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的实验,回答问题:
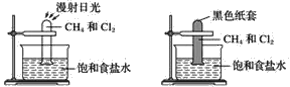
(1)装置A中的实验现象是____________________装置B中的实验现象是____
(2)根据上述实验,你能得出的结论是________________________________
(3)写出上述实验A中反应的化学方程式:
____________________________________________________;
____________________________________________________;
___________________________________________________;
______________________________________________________。
(4)上述反应的反应类型是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:A(g)+3B(g)![]() 2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是
2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系的压强不再发生变化B.3v正(B)=2v逆(C)
C.混合气体密度不再变化D.消耗1molA的同时生成2molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸________mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______。
(3)容量瓶使用前检验漏水的方法是_______。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,_______________;
②摇匀后发现液面低于刻度线再加水,_____________;
③容量瓶中原有少量蒸馏水,_______________;
④定容时观察液面俯视,_____________;
⑤未将洗涤液注入容量瓶中,_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com