
【题目】根据下图所示的实验,回答问题:
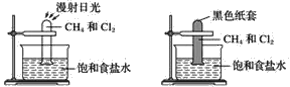
(1)装置A中的实验现象是____________________装置B中的实验现象是____
(2)根据上述实验,你能得出的结论是________________________________
(3)写出上述实验A中反应的化学方程式:
____________________________________________________;
____________________________________________________;
___________________________________________________;
______________________________________________________。
(4)上述反应的反应类型是________________________
【答案】装置A中:①试管内气体颜色逐渐变浅②试管内壁有油状液滴出现③试管中有少量白雾④试管内液面上升⑤水槽中有固体析出 装置B中无明显现象 甲烷与氯气在光照时才能发生化学反应 CH4+Cl2![]() CH3Cl+HCl CH3Cl+Cl2
CH3Cl+HCl CH3Cl+Cl2![]() CH2Cl2+HCl CH2Cl2+Cl2
CH2Cl2+HCl CH2Cl2+Cl2![]() CHCl3+HCl CHCl3+Cl2
CHCl3+HCl CHCl3+Cl2![]() CCl4+HCl 取代反应
CCl4+HCl 取代反应
【解析】
(1)根据甲烷与氯气的反应实验条件和产物性质,分析判断实验现象;
(2)根据甲烷与氯气在不同条件下的实验现象推断结论;
(3)利用甲烷取代反应特点书写反应方程式;
(4)根据上述反应的特点判断反应类型;
(1)装置A中是甲烷与氯气在光照的条件下发生取代反应,所以装置A中的实验现象为①试管内气体颜色逐渐变浅,因为氯气被反应掉了②试管内壁有油状液滴出现,因为有四氯化碳的产生③试管中有少量白雾;产生的氯化氢与水面上的小水滴结合④试管内液面上升,试管内的产生的氯化氢会溶解在水中试管中的气压减小⑤水槽中有固体析出,因为产生的HCl溶于水使氯离子的浓度升高所以会有氯化钠晶体析出;装置B中的试管用黑色纸套套住无法进行反应,所以实验现象为装置B中无明显现象;
(2)根据上述实验现象,可以得出结论甲烷与氯气在光照时才能发生化学反应;
(3)上述实验A中反应的化学方程式:CH4+Cl2![]() CH3Cl+HCl、CH3Cl+Cl2
CH3Cl+HCl、CH3Cl+Cl2![]() CH2Cl2+HCl、CH2Cl2+Cl2
CH2Cl2+HCl、CH2Cl2+Cl2![]() CHCl3+HCl、 CHCl3+Cl2
CHCl3+HCl、 CHCl3+Cl2![]() CCl4+HCl;
CCl4+HCl;
(4)上述反应的反应类型是取代反应;


科目:高中化学 来源: 题型:
【题目】对可逆反应N2+3H2![]() 2NH3,用v(H2)和v(N2)分别表示其中的化合反应的速率,用v(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
2NH3,用v(H2)和v(N2)分别表示其中的化合反应的速率,用v(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
A.3v(N2)=v(H2)
B.v(H2)=v(NH3)
C.2v(H2)=3v(NH3)
D.v(N2)=3v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
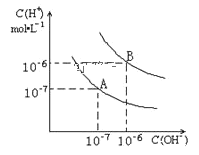
(1)25℃时,水的电离平衡曲线应为_________请说明理由_________
(2)95℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为_________
(3)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为______;反应
H2(g)+I2(g)的平衡常数K2为______;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3为________。
HI(g)的平衡常数K3为________。
(II)在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)该反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L1,c(H2)=1.5mol·L1,c(CO)=1mol·L1,c(H2O)=3mol·L1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是( )
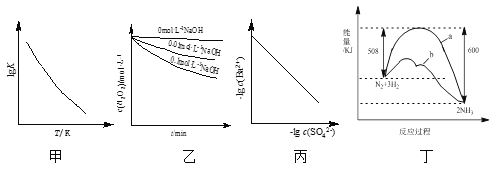
A.图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
B.图乙是70℃时不同pH条件下H2O2浓度随时间的变化曲线。说明其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO![]() )的关系曲线,说明溶液中c(SO
)的关系曲线,说明溶液中c(SO![]() )越大c(Ba2+)越小
)越大c(Ba2+)越小
D.图丁是合成氨反应过程中能量变化曲线,说明该反应为放热反应,且b表示在反应体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.向0.1mol·L-1的CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
B.相同浓度的CH3COONa和HCOONa的混合溶液中:c(Na+)>c(HCOO-)>c(CH3COO-)>c(OH-)
C.c(NH![]() )相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
)相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
D.0.1mol·L-1的CH3COOH溶液和0.05mol·L-1的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)已知:H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1
SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
则硫化氢气体分解为氢气和固体硫的热化学方程式为___。
(2)K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
(已知:H2CO3lgK1=-6.4,lgK2=-10.3;H2SlgKl=-7.0,lgK2=-19.0)。
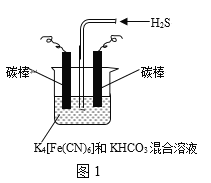
(3)工业上采用图1所示装置电解K4[Fe(CN)6]和KHCO3混合溶液一段时间,然后停止电解,通入H2S,利用生成的K3[Fe(CN)6]将H2S转化为S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___。
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() 。通H2S发生反应的离子反应方程式为___。
。通H2S发生反应的离子反应方程式为___。
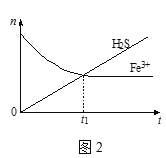
(4)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图2所示。t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是___。
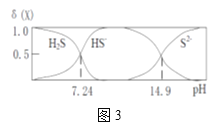
(5)H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图3所示,H2S的电离平衡常数Ka1=___。写出pH由12.0变为16.0时发生的主要的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g-OH中含有的电子数为10NA
B.25°C时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C.1L1molL-1CH3COONH4溶液中CH3COO-与NH4+数目均为NA
D.含0.5mol晶胞(下图)的Cu2O晶体中Cu2+的数目为2NA

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)当前,产量最高,用途最广的金属是_____________。
(2)这三种金属的金属活动性由强到弱的顺序是_______________ 。
(3)硫酸铁有净水的作用。写出硫酸铁的电离方程式:_____________ 。
(4)小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_____(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(5)足量的铝与氢氧化钠溶液反应后得到标准状况下的氢气2.24L,则参加反应的铝的质量为_____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com