
【题目】下图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,回答下列问题:

(1)若用Na2CO310H2O来配制溶液,需要用电子天平称量晶体_____克。若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)。
(2)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(3)步骤B称为转移,步骤A称为_____,如果俯视刻度线,配制的浓度将偏_____(填大或小)。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(4)将上述实验步骤A﹣F按实验过程先后次序排列_____。
【答案】2.860 大 100mL容量瓶、胶头滴管、玻璃棒 定容 大 洗涤 小 C、B、D、F、A、E
【解析】
(1)实验室配制100mL 0.100molL﹣1 Na2CO3溶液需要Na2CO3的物质的量为:0.1L×0.1mol/L=0.01mol,Na2CO310H2O的物质的量为0.01mol,Na2CO310H2O的质量为:0.01mol×286g/mol=2.86g,电子天平的精确度为0.001g,所以需要称量晶体为2.860g;若所取的晶体已经有一部分失去了结晶水,溶质碳酸钠的质量偏大,即n偏大,根据c=![]() 分析可知溶液的浓度偏大,
分析可知溶液的浓度偏大,
故答案为:2.860;大;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管、玻璃棒;
(3)加水至液面距离刻度线1~2cm时,用胶头滴管向容量瓶中滴加溶液,该操作的名称是定容;
如果俯视刻度线,溶液的体积偏小,根据c=![]() 分析可知配制的浓度将偏大;
分析可知配制的浓度将偏大;
转移后,用蒸馏水洗涤玻璃棒的操作名称是洗涤;
若没有洗涤,溶质的物质的量偏小,根据c=![]() 分析可知配制的浓度将偏小;
分析可知配制的浓度将偏小;
故答案为:定容;大;洗涤;小;
(4)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,所以实验过程先后次序排列为:C、B、D、F、A、E,
故答案为:C、B、D、F、A、E。


科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
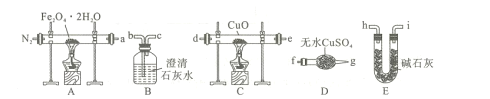
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强的密闭容器中,将平均分子质量为8.5的N2和H2混合,随后在一定条件下合成氨,当反应达到平衡时测得混合气体的平均分子质量为10。
(1)反应前N2和H2的体积比为_____;
(2)氮气的平衡转化率;_____________
(3)平衡混合气中氨气的体积分数。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在大试管内将足量NaHCO3加热到 200℃,将产生的混合气体通入到盛有1.87 g Na2O和Na2O2的密闭容器中,待Na2O和Na2O2全部反应后,得到标准状况下224 mL O2;再将反应后密闭容器内的固体全部溶于水配成 100 mL 溶液。下列说法正确的是
A.Na2O和Na2O2 均为碱性氧化物
B.参加反应的NaHCO3物质的量为 0.04 mol
C.反应过程中总共转移 0.04 mol 电子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4,1 mol P参加反应转移的电子数为______,被氧化的磷与被还原的磷的质量比为______,1 mol CuSO4可以氧化______mol的磷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com