
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,回答下列问题:

(1)若用Na2CO310H2O来配制溶液,需要用电子天平称量晶体_____克。若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)。
(2)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(3)步骤B称为转移,步骤A称为_____,如果俯视刻度线,配制的浓度将偏_____(填大或小)。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(4)将上述实验步骤A﹣F按实验过程先后次序排列_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O4·2H2O是染料工业中常用的还原剂,俗称保险粉它可溶于氢氧化钠溶液并稳定存在,难溶于乙醇,受热易分解,制备保险粉的流程如下:
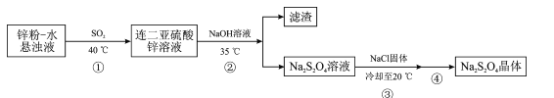
回答下列问题:
(1)保险粉的制备过程要在无氧条件下进行,原因是__________
(2)若用Na2SO3固体和酸反应制备SO2气体,下列最适宜选用的酸是____(填标号)
A.浓盐酸 B.稀硝酸 C.70%硫酸 D.98%硫酸
(3)步骤②需要控制温度在35℃的原因是__________已知pH>11时,Zn(OH) 2转化为![]() ,为了使Zn2+沉淀完全,则加入氢氧化钠溶液调节溶液的pH范围是______________(25℃时Ksp[Zn(OH)2]=1.0×1017,35℃时Ksp与Kw的变化可忽略)
,为了使Zn2+沉淀完全,则加入氢氧化钠溶液调节溶液的pH范围是______________(25℃时Ksp[Zn(OH)2]=1.0×1017,35℃时Ksp与Kw的变化可忽略)
(4)步骤③中加入一定量NaCl固体的目的是____
(5)步骤④的操作是__________经干燥得Na2S2O4·2H2O样品
(6)为了测定Na2S2O4·2H2O样品纯度,取mg样品溶解在足量的甲醛溶液中,配制成100.00mL溶液取10.00mL溶液于锥形瓶中,用cmol/L碘标准液滴定至终点,消耗标准液的体积为VmL测定过程中,发生的反应:Na2S2O4+2HCHO+H2O═NaHSO3CH2O+NaHSO2CH2O,NaHSO2CH2O+2I2+2H2O═NaHSO4+HCHO+4HI,则样品中Na2S2O4·2H2O的纯度为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定体积的的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达到平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达到平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
A.0.16B.0.08C.0.04D.0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列10种物质:①Al ②稀硝酸 ③乙酸 ④液氨 ⑤干冰 ⑥NaCl ⑦NaOH溶液 ⑧BaCO3 ⑨酒精 ⑩HCl气体,完成下面的填空,只填序号
属于非电解质的是___;属于强电解质的是___;属于弱电解质的是___;能导电的物质是___。
(2)已知在常温常压下:
①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g) △H=﹣akJmol﹣1
②2CO(g)+O2(g)═2CO2(g) △H=﹣bkJmol﹣1
③H2O(g)═H2O(l) △H=﹣ckJmol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为___。
(3)Na2CO3等溶液不能存放在磨口玻璃塞的试剂瓶中,其原因是(结合离子方程式说明):___;把三氯化铁溶液蒸干并充分灼烧,最后得到的固体产物是___(化学式);相关反应的化学反应方程式是:___、___;配制FeCl2溶液时,应加入___,以抑制Fe2+的水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式是2NaIO3+5NaHSO3===3NaHSO4+2Na2SO4+I2+H2O
(1)反应中______元素被氧化,_______是氧化剂。
(2)用“双线桥”标出电子转移的方向和数目。_________。
(3)反应产物中,氧化产物与还原产物的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种柔性水系锌电池为可充电电池,以锌盐溶液作为电解液,其原理如图所示。下列说法正确的是( )
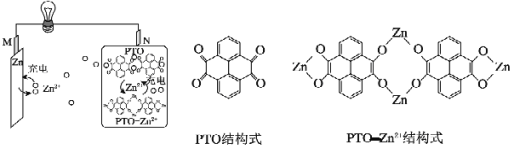
A.充电时,Zn2+向N极移动
B.充电时,N极的电极反应式为PTO—Zn2+-8e-= 2PTO + 4Zn2+
C.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20g(已知F=96500C·mol-1)
D.放电时,每生成1mol PTO—Zn2+,M极溶解Zn的质量为65g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com