
����Ŀ���������CuMn2O4�����ڳ����´����������е�һ����̼�ͼ�ȩ��HCHO����
��1����Ԫ��λ�ڵ������ڵڢ�B�壮��̬Mn2+�ĺ�������Ų�ʽΪ �� NO3���Ŀռ乹��Ϊ ��
��2��HCHO�к��еĦҼ��ͦм���Ŀ֮��Ϊ ��
��3����ɽ������ҽ��к��ж��������ȴʱZnS��HgS��������ԭ����
��4��Cu3N�γɵľ���ṹ��ͼ��ʾ������ͬһ��N3��������Cu+������Cu+�İ뾶Ϊa pm��N3���İ뾶Ϊb pm����Cu3N���ܶ�Ϊgcm��3 �� ��ֻ��ʽ�����ü����������������ӵ�������NA��ʾ��1pm=10��10 cm�� 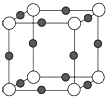
���𰸡�
��1��1s22s22p63s23p63d5��ƽ��������
��2��3��1
��3�����߾�Ϊ���Ӿ��壬ZnS�����ܴ���HgS�����ZnS������
��4��6��![]()
���������⣺��1.��Mn��ԭ������Ϊ25����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d54s2 �� ��Mn2+��̬�ĵ����Ų�ʽ�ɱ�ʾΪ1s22s22p63s23p63d5����[Ar]3d5����NO3����Nԭ���γ�3���ļ���û�йµ��Ӷԣ���ӦΪƽ�������Σ����Դ��ǣ�1s22s22p63s23p63d5��ƽ�������Σ�
��2.����ȩ�ĽṹʽΪ ![]() �������к���2��C��H����1��C=O��������Ϊ�Ҽ���˫���о���1���Ҽ���1�м����ʷ����ЦҼ��ͦм���Ŀ��Ϊ3��1�����Դ��ǣ�3��1��
�������к���2��C��H����1��C=O��������Ϊ�Ҽ���˫���о���1���Ҽ���1�м����ʷ����ЦҼ��ͦм���Ŀ��Ϊ3��1�����Դ��ǣ�3��1��
��3.�����߾�Ϊ���Ӿ��壬ZnS�����ܴ���HgS�����ZnS�����������Դ��ǣ����߾�Ϊ���Ӿ��壬ZnS�����ܴ���HgS�����ZnS��������
��4.�������к�ɫ����ĿΪ12�� ![]() =3����ɫ����ĿΪ8��
=3����ɫ����ĿΪ8�� ![]() =1���ʺ�ɫ��ΪCu+ �� ��ɫ��ΪN3�� �� �ɾ����ṹ��֪�����ϵ�Cu+��N3����������N3��Ϊ���ģ���X��Y��Z�������ϣ���ÿ�����ϵȾ����Cu+��2������ͬһ��N3��������Cu+��6�������������=[��2a+2b����10��10cm]3 �� Cu3N���ܶ�=
=1���ʺ�ɫ��ΪCu+ �� ��ɫ��ΪN3�� �� �ɾ����ṹ��֪�����ϵ�Cu+��N3����������N3��Ϊ���ģ���X��Y��Z�������ϣ���ÿ�����ϵȾ����Cu+��2������ͬһ��N3��������Cu+��6�������������=[��2a+2b����10��10cm]3 �� Cu3N���ܶ�= ![]() =
= ![]() g/cm3 �� ���Դ��ǣ�6��
g/cm3 �� ���Դ��ǣ�6�� ![]() ��
��


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������У��������ԭ��ص��ǣ� ��
A | B | C | D | |
�������� | пƬ��ʯī | пƬ��ͭƬ | ͭƬ��ʯī | ��Ƭ��ͭƬ |
������Һ | ������Һ | ��ˮ�Ҵ� | ��������Һ | ϡ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��a��b��c��d��ԭ��������������b��cΪ���ֳ����Ľ���Ԫ�أ�a��b��c��d������������Ӧ��ˮ��������Ϊ�ס��ҡ�������������֮�������ͼ��ʾ�ķ�Ӧ��ϵ(ͼ���á�--���������������ʼ��ܷ�����Ӧ)�������ж�һ����ȷ����
A. �����Ӱ뾶:d>b>c>a
B. �����ʵ�����ba3��b3a�����������������
C. d������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ6
D. b��d��ɵĻ������ˮ��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ѣ�CH3OCH3������Ϊ21���͵�����ȼ�ϣ�����ࡢ��Ч�����������Ļ������ܣ�������һ����ɫ���壬������������ζ����ȼ����Ϊ1455kJ/mol�����ѿ���ȼ�ϵ�ص�ȼ�ϣ�
��1����֪H2��g����C��s����ȼ���ȷֱ���285.8kJmol��1��393.5kJmol��1�����㷴Ӧ4C��s��+6H2��g��+O2��g���T2CH3OCH3��g���ķ�Ӧ��Ϊ��
��2����ҵ������H2��CO2�ϳɶ����ѵķ�Ӧ���£�6H2��g��+2CO2��g��CH3OCH3��g��+3H2O��g����H��0
��һ���¶��£���һ���̶�������ܱ������н��и÷�Ӧ���������жϷ�Ӧ�ﵽ��ѧƽ��״̬������ѡ���ţ�ע���Сд��
a��c��H2����c��H2O���ı�ֵ���ֲ���
b����λʱ������2mol H2����ʱ��1mol H2O����
c�������������ܶȲ��ٸı�
d������������ѹǿ���ٸı�
���¶����ߣ��û�ѧƽ���ƶ����µ�ƽ�⣬CH3OCH3�IJ��ʽ�����������С�����䡱����ͬ������������ƽ��ʽ������
��3���Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ��õ�صĸ�����ӦʽΪ��
��4���ã�3���е�ȼ�ϵ��Ϊ��Դ����ʯīΪ�缫���500mL���з�̪��NaCl��Һ��װ����ͼ��ʾ����д����������Y�缫�����۲쵽����������ȼ�ϵ������2.8LO2����״���£�ʱ�������ʱ��NaCl��Һ��pH=��������Һ��������䣬����ȫ������Һ���ݳ�����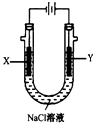
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯���(LiAlH4)���л��ϳ��е���Ҫ��ԭ����ij���������ʵ���Ʊ��⻯��﮲��ⶨ�䴿�ȡ���֪: �⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ������ͬһ�����塣
I.�Ʊ��⻯�
ѡ��ͼI�е�װ���Ʊ��⻯�(��Щװ�ÿ��ظ�ʹ��):
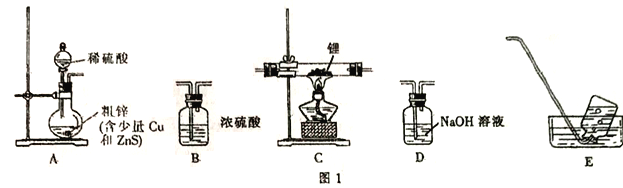
��1��װ�õ�����˳��(��������)ΪA��______________��
��2�����ں�װ��װ�õ������ԣ���ȼ�ƾ���ǰ����е�ʵ�������_______________��
��3��д���Ʊ��⻯��﮵Ļ�ѧ����ʽ:__________________��
II. �Ʊ��⻯���
1947����Schlesinger,Bond��Finholt�״��Ƶ��⻯��ﮣ��䷽����ʹ�⻯�����ˮ���Ȼ�����һ�������������л������������ַ�Ӧ������һϵ�в����õ�LiAlH4���塣
��4��д���⻯�����ˮ���Ȼ�����Ӧ�Ļ�ѧ����ʽ:____________________��
III.�ⶨ�⻯��﮲�Ʒ(�����⻯�)�Ĵ���
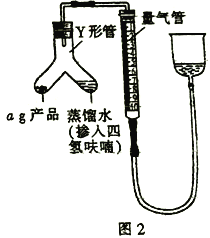
��5����ͼ2װ�����������װ�������Բ�װ��ҩƷ(Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ�),������Ӧ�IJ�����________������֮ǰ�����ƶ��������Ҳ��������ʹ�����������������Һ����ͬһˮƽ���ϣ���Ŀ����_________��
��6���ڱ�״���£���Ӧǰ�����ܶ���ΪV1mL����Ӧ��ϲ���ȴ֮�������ܶ���ΪV2mL������Ʒ�Ĵ���Ϊ_____________(�ú�a��V1��V2�Ĵ���ʽ��ʾ)�������ʼ����ʱ���ӿ̶�������õĽ����________(�ƫ������ƫ����������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ԫ�����ڱ��ش��������⣺
��1�����е�ʵ����Ԫ�����ڱ��IJ��ֱ߽磬����ͼ����ʵ�߲�ȫԪ�����ڱ��ı߽硣____________
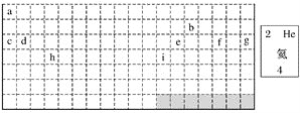
��2����������Ԫ�أ����ڶ�����Ԫ�ص���________����������Ԫ�ص���________��
��3��gԪ��λ�ڵ�________���ڵ�________�壻iԪ��λ�ڵ�________���ڵ�________�塣
��4��Ԫ��f�ǵ�________���ڵ�________��Ԫ�أ��밴��Ԫ�ص�ʽ��д����Ԫ�ص�ԭ��������Ԫ�ط��š�Ԫ�����ơ����ԭ��������____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����1.0 mL 0.1mol/L��ˮ�������ж���ȷ����
A. c��OH-��=c��NH4+�� B. ��1.0mL 0.1mol/L�����Ϻ���Һ������
C. ��Һ��pHС��13 D. ��������NH4Cl���壬c��OH-������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ʾ���л����У����������ŵ�ͬ���칹����Ŀ�����ǣ� ��
A.C4H10O
B.C4H10
C.C3H6O
D.C4H7Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������˵������ȷ���ǣ�
A.�����ǿ����������ΪH+��������
B.��ͬ�����£�Ũ�����ϡ����Ļ�ԭ���ﲻͬ
C.�������������������
D.Ũ�����ֽ⣬Ӧ������ɫƿʢװ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com