
【题目】下列电子式书写正确的是( )
①氧原子![]() ②过氧根离子
②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]() ④钠离子
④钠离子![]() ⑤氢离子
⑤氢离子![]() ⑥铵根离子
⑥铵根离子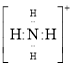 ⑦铝原子
⑦铝原子![]() ⑧溴离子
⑧溴离子![]()
A.①②③⑥⑦B.①③④⑥⑦⑧C.①③⑤⑥⑦⑧D.②③④⑦⑧
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将 CH3COOH和CH3COONa共0.1配制成1L溶液,溶液中CH3COOH和CH3COO—各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。下列说法不正确的是

A.25℃时, CH3COO—的水解平衡常数为10—9.24
B.pH=4.76时,加入的CH3COOH和CH3COONa物质的量相等
C.pH<4.76时,一定有c(CH3COO—)+c(OH—)>c(H+)
D.4.76<pH<7时,c(CH3COO—)>c( Na+)>c(H+)>c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向水中通入NO2:2NO2+H2O=2H++NO![]() +NO
+NO
B.向NH4HCO3溶液中加入过量NaOH溶液:HCO![]() +OH-=CO
+OH-=CO![]() +H2O
+H2O
C.向稀硝酸中加入FeO:3FeO+NO![]() +10H+=3Fe3++NO↑+5H2O
+10H+=3Fe3++NO↑+5H2O
D.向Na2SO3溶液中加入酸性K2Cr2O7溶液:3SO![]() +Cr2O
+Cr2O![]() +2H2O=3SO
+2H2O=3SO![]() +2Cr3++6OH-
+2Cr3++6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢合成CH4的过程中主要发生下列反应:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)![]() 2CO2(g) ΔH3=-566.0kJ·mol-1
2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是( )
A.CH4的燃烧热为802.0kJ·mol-1
B.反应②能自发进行的原因是ΔS<0
C.使用催化剂是为了提高CO2加氢时原料的平衡转化率
D.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH=-165.2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
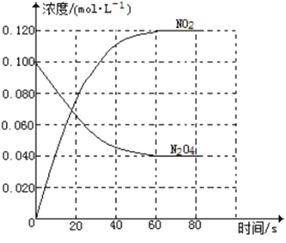
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在25 ℃条件下将pH=12的氨水稀释过程中,下列关系式正确的是________。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
②在25 ℃条件下将pH=12的氨水稀释100倍后溶液的pH为________(填序号)。
A.10 B.11 C.10~12 D.11~13
(2)25 ℃时,向0.1 mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是________(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①________和________两种粒子的物质的量之和等于0.2 mol。
②________和________两种粒子的物质的量之和比OH-多0.1 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用煤化工所得的苯可合成甲苯、乙苯、环己烷,其反应如下:
①![]()
![]()
![]() (甲苯)
(甲苯)![]()
②![]()
![]()
![]()
 (乙苯)
(乙苯)
③![]()
![]()
![]()
![]() (环己烷)
(环己烷)
下列说法正确的是( )
A.反应①、②、③均属于加成反应
B.溴水中加入苯,二者可发生取代反应
C.甲苯中所有原子一定在同一平面上
D.能用溴的四氯化碳溶液判断反应②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子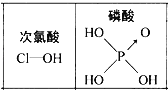
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com