
| 9 |
| 18 |
| 22 |
| 44 |
 ,甲、丙、丁、己均能发生银镜反应.丙不易溶于水但丁易溶于水,丙为HCOOCH3,丁中含-OH,则丁为CH2OHCHO,然后结合有机物的结构和性质来解答.
,甲、丙、丁、己均能发生银镜反应.丙不易溶于水但丁易溶于水,丙为HCOOCH3,丁中含-OH,则丁为CH2OHCHO,然后结合有机物的结构和性质来解答.| 9 |
| 18 |
| 22 |
| 44 |
 ,甲、丙、丁、己均能发生银镜反应.丙不易溶于水但丁易溶于水,丙为HCOOCH3,丁中含-OH,则丁为CH2OHCHO,
,甲、丙、丁、己均能发生银镜反应.丙不易溶于水但丁易溶于水,丙为HCOOCH3,丁中含-OH,则丁为CH2OHCHO,| △ |
| △ |


科目:高中化学 来源: 题型:
| A、称取10.0gNaOH,加入500mL水 |
| B、称取10.0gNaOH,选取500mL容量瓶进行配制 |
| C、称取9.6gNaOH,选取480mL容量瓶进行配制 |
| D、称取9.6gNaOH,选取500mL容量瓶进行配制 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在原电池中,电子流出的一极是负极,发生氧化反应 |
| B、原电池是将化学能转变为电能的装置 |
| C、构成原电池的正极和负极必须是两种不同的金属 |
| D、原电池放电时,在外电路电子的流动方向是从负极到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸 | B、氧化物 | C、有机物 | D、钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
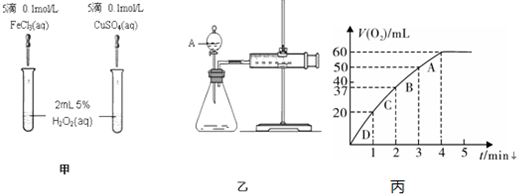
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | 303 | 213 | 323 |
| 平衡时NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com