
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
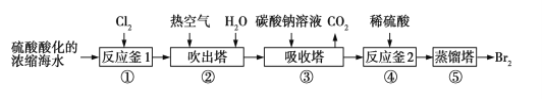
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种晶体可表示为[MxFey(CN)z],研究表明它的结构特性是Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子晶胞结构如图所示,下列说法正确的是( )
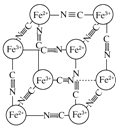
A.该晶体属于原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度各为1 mol/L的FeCl3 、FeCl2 、CuCl2 的混合溶液100 mL,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后,铁粉有剩余。
①反应完毕后,溶液中一定含有__________阳离子,为__________mol,一定没有__________阳离子。
②固体物质烘干后,其中一定有__________和__________,和反应前加入的铁粉质量相比__________(填“多”或“少”)__________g。
(2)反应完毕后,有铜生成,铁粉无剩余。
①反应后的溶液中一定含有__________阳离子,该阳离子在溶液中的物质的量的范围是__________。
②溶液中可能含有__________阳离子,该阳离子在溶液中物质的量的可能存在范围是__________。
③溶液中一定不含__________阳离子。
④溶液的质量__________(填“增加”或“减少”)。
(3)反应完毕后,无固体沉淀物存在,反应后的溶液中一定含__________和__________阳离子,它们中物质的量为定值的是__________阳离子,为__________mol;它们中的物质的量为一数值范围的是__________阳离子,该数值范围是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X是直流电源。Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒。接通电路后,发现d附近溶液显红色。

(1)①电源b极为________(填“正”“负”或“阴”“阳”,下同)极。
②Z烧杯中e为________极。
③连接Y、Z烧杯线路中,电子流动的方向是d________(填“→”或“←”)e。
(2)①写出Y烧杯中c极上的电极反应式:_______________________________
②写出Y烧杯中总反应的化学方程式:________________________________
③写出Z烧杯中e极上的电极反应式:_______________________________
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______mol。
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如下图所示
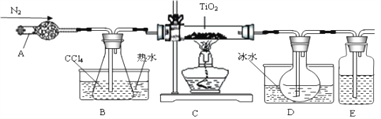
有关物质的性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
下列说法正确的是
A. A和E分别盛装碱石灰和氢氧化钠溶液
B. 点燃C处酒精灯后再往A中通入N2
C. TiCl4遇潮湿空气反应的化学方程式:TiCl4+3H2O=H2TiO3+4HCl
D. 分离D中的液态混合物,所采用操作的名称是萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期。下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物。下列分析正确的是
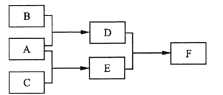
A. Y的氢化物在常温下是液体
B. 与Y同周期氢化物中D最稳定
C. Z的含氧酸均为强酸
D. F含离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用H2还原WO3(黄色)粉末测定W(银白色)的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
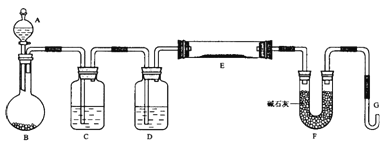
请回答下列问题:
(1)仪器B的名称____________,C中水的作用是_______________________________;
(2)D中盛放的试剂是___________,其作用是___________________________________;
(3)实验过程中有下面几步:①加热反应管E,②从仪器A逐滴滴加液体,③由仪器G收集气体并检验纯度,④待E试管冷却后,停止从A中滴加液体。正确的实验操作顺序是_____;
(4)E中反应的化学方程式_____________________________________________________,
E中产生的现象为___________________________________________________________;
(5)本实验样品WO3为纯净物,且完全被还原。若测得如下数据①空E管的质量a ②E管和WO3的总质量b;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛装物的总质量d;⑤反应后F管及内盛装物的总质量e。由以上数据可以列出计算W的相对原子质量的不同计算式(除W外,其他涉及的元素的相对原子质量均为已知),请写出其中一个。Ar(W)=___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物B.液氯和氯水都有酸性
C.液氯和氯水都有漂白性D.液氯无色,氯水呈黄绿色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com