
【题目】现有浓度各为1 mol/L的FeCl3 、FeCl2 、CuCl2 的混合溶液100 mL,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后,铁粉有剩余。
①反应完毕后,溶液中一定含有__________阳离子,为__________mol,一定没有__________阳离子。
②固体物质烘干后,其中一定有__________和__________,和反应前加入的铁粉质量相比__________(填“多”或“少”)__________g。
(2)反应完毕后,有铜生成,铁粉无剩余。
①反应后的溶液中一定含有__________阳离子,该阳离子在溶液中的物质的量的范围是__________。
②溶液中可能含有__________阳离子,该阳离子在溶液中物质的量的可能存在范围是__________。
③溶液中一定不含__________阳离子。
④溶液的质量__________(填“增加”或“减少”)。
(3)反应完毕后,无固体沉淀物存在,反应后的溶液中一定含__________和__________阳离子,它们中物质的量为定值的是__________阳离子,为__________mol;它们中的物质的量为一数值范围的是__________阳离子,该数值范围是__________。
【答案】 Fe2+ 0.35 Fe3+ 和Cu2+ Fe Cu 少 2.0 Fe 2+ 0.25 mol<n(Fe2+ )≤0.35 mol Cu2+ 0<n(Cu2+)<0.1 mol Fe3+ 增加 Fe2+ Cu2+ Cu2+ 0.1 Fe2+ 0.1 mol<n(Fe2+)≤0.25 mol
【解析】
根据FeCl3、CuCl2的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体铜剩余,则一定无三价铁离子存在,一定存在亚铁离子,可能含有铜离子;若有铁剩余,一定有铜生成,三价铁离子和二价铜离子无剩余;无固体沉积物存在,说明铁粉不足,溶液中的铜离子没有参与反应;据此分析解答。
(1)当铁粉有剩余时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe═3FeCl2、CuCl2+Fe═Cu+FeCl2,
①溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;反应后溶液中的溶质为氯化亚铁,根据氯离子守恒:n(Cl-)=(1mol/L×3+1mol/L×2+1mol/L×2)×0.1L=0.7mol,所以n(Fe2+)=![]() n(Cl-)=0.35mol;故答案为:Fe2+;0.35;Fe3+、Cu2+;
n(Cl-)=0.35mol;故答案为:Fe2+;0.35;Fe3+、Cu2+;
②根据方程式;2FeCl3+Fe═3FeCl2、CuCl2+Fe═Cu+FeCl2,反应消耗铁的量为n(Fe)= ![]() n(FeCl3)+n(Cu)=
n(FeCl3)+n(Cu)=![]() ×1mol/L×0.1L+1mol/L×0.1L=0.15mol,所以铁的质量为:0.15mol×56g/mol=8.4g,反应生成的铜为n(Cu)=1mol/L×0.1L=0.1mol,所以铜的质量为;0.1mol×64g/mol=6.4g,固体质量减少8.4g-6.4g=2g;故答案为:Cu;Fe;少;2;
×1mol/L×0.1L+1mol/L×0.1L=0.15mol,所以铁的质量为:0.15mol×56g/mol=8.4g,反应生成的铜为n(Cu)=1mol/L×0.1L=0.1mol,所以铜的质量为;0.1mol×64g/mol=6.4g,固体质量减少8.4g-6.4g=2g;故答案为:Cu;Fe;少;2;
(2)当有铜生成,铁粉无剩余,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;
①如果只有Fe2+,则其物质的量为:0.35mol,如果还有Cu2+,且最多为0.1mol时,只发生2FeCl3+Fe=3FeCl2,则Fe2+物质的量为0.25mol,由于两个反应都发生,所以Cu2+小于0.1mol,因此Fe2+物质的量大于0.25mol,故Fe2+物质的量为:0.25mol<n(Fe2+)≤0.35mol;故答案为:Fe2+;0.25mol<n(Fe2+)≤0.35mol;
②若铜离子全部反应则剩余物质的量为0,若没有反应则剩余物质的量为0.1mol,所以铜离子的物质的量范围为:0≤n(Cu2+)<0.1mol;故答案为:Cu2+;0≤n(Cu2+)<0.1mol;
③溶液中一定不含Fe3+,故答案为:Fe3+;
④根据(1)中②的分析可知,固体质量减少,则溶液质量增加,故答案为:增加;
(3)反应完毕后,无固体沉积物存在,说明溶液中的铜离子没有参加反应,铁离子可能恰好反应,有可能有剩余,反应后的溶液中一定存在Fe2+、Cu2+;不管铁离子是否有剩余,铜离子的物质的量为定值,物质的量=1mol/L×0.1L=0.1mol;若铁离子没有反应,则亚铁离子的物质的量为0.1mol,若铁离子完全反应,则亚铁离子为0.25mol,因此亚铁离子在0.1 mol<n(Fe 2+ )≤0.25 mol范围内,故答案为:Fe2+;Cu2+;Cu2+;0.1mol ;Fe 2+;0.1 mol<n(Fe 2+ )≤0.25 mol。


科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A. H2O+H2O ![]() H3O++OH- B. HCO3-+OH-
H3O++OH- B. HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
C. CO2+H2O ![]() H2CO3 D. CO32-+H2O
H2CO3 D. CO32-+H2O ![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2 (g) +3H2 (g) ![]() CH30H(g)十H2 O (g)△H= -25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是
CH30H(g)十H2 O (g)△H= -25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是

A. 刚开始反应时速率:甲>乙
B. 平衡后反应放热;甲>乙
C. 500℃下该反应平衡常数:K =3×102
D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如今人们把食品分为绿色食品、蓝色食品、白色食品等类型.绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品.下面属于蓝色食品的是( )
A.食醋
B.面粉
C.海带
D.白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____极(填“正”或“负”)。铜片上产生的现象为______,该极上发生的电极反应为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图装置在铁皮上镀一层锌,以下叙述错误的是( )
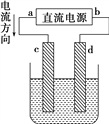
A. 电镀前,铁皮可用热碱溶液除油渍,盐酸除铁锈
B. c为铁,d为锌
C. 用含Zn2+的盐配成电解质溶液
D. 电镀时,发生氧化反应和还原反应的都是锌元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
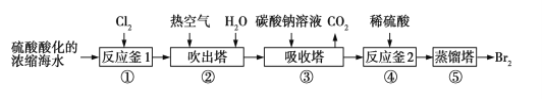
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B. 电镀时,通常把待镀金属制品作阴极,镀层金属作阳极
C. 常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0
D. 工业通过反应“Na(l)+KCl(l) ![]() NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com