
【题目】氯的化合物与人们的生活紧密相关。回答下列问题:
(1)高血压患者,应该减少食盐的摄入量,为了“减盐不减咸”,建议高血压患者食用低钠盐(含氯化钾30%左右的氯化钠)。我们可以通过________________(操作名称)来检验食盐中含有钾元素,得到食盐中含钾元素的实验依据是___________。
(2)瑞典化学家舍勒(Carl Wilhelm Scheele)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首次制得了氯气。实验室用下图所示装置制取纯净的氯气。
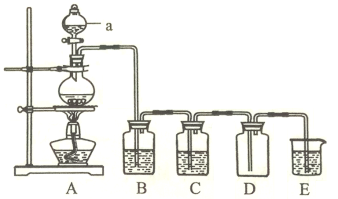
①仪器a的名称为______________。
②装置A中发生反应的离子方程式为_____________________________。
③装置B的作用是_____________,装置C中的试剂为_____________。
④装置E中发生反应的离子方程式为__________________。
⑤当有4molHCl被氧化时,产生的氯气在标准状况下的体积为__________L。
(3)漂白液(有效成分是NaClO)与洁厕灵(主要成分为盐酸)混合,也会产生Cl2,请写出该反应的离子方程式__________。
【答案】焰色反应 透过蓝色钴玻璃观察火焰颜色呈紫色 分液漏斗 MnO2+4H++Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的HCl气体 浓硫酸 Cl2+2OH-=Cl-+ ClO-+2H2O 44.8 Cl-+ ClO-+2H+= Cl2↑+H2O
Mn2++Cl2↑+2H2O 除去氯气中的HCl气体 浓硫酸 Cl2+2OH-=Cl-+ ClO-+2H2O 44.8 Cl-+ ClO-+2H+= Cl2↑+H2O
【解析】
根据焰色反应的原理分析解答;根据氯气的实验室制备原理及装置图分析装置的名称、作用及发生的相关反应;根据氯气的化学性质书写相关离子方程式。
(1)钾元素的检验可以用焰色反应来检验,实验现象是透过蓝色钴玻璃观察火焰颜色呈紫色,故答案为:焰色反应;透过蓝色钴玻璃观察火焰颜色呈紫色;
(2)①如图所示,a为分液漏斗;
②装置A为氯气的发生装置,其中反应为二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
③由图示装置及实验目的分析知,B、C装置是除杂装置,则B的目的是除去氯气中的HCl气体,C装置是干燥装置,C中试剂为浓硫酸;
④装置E是尾气处理装置,氯气通入氢氧化钠溶液中,反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ ClO-+2H2O;
⑤反应中HCl未全部被氧化,被氧化的部分生成Cl2,则n(Cl2)=1/2n(HCl)=1/2×4mol=2mol,V(Cl2)=22.4L/mol×2mol=44.8L;
故答案为:分液漏斗;MnO2+4H++Cl-![]() Mn2++Cl2↑+2H2O;除去氯气中的HCl气体、浓硫酸;Cl2+2OH-=Cl-+ ClO-+2H2O;44.8;
Mn2++Cl2↑+2H2O;除去氯气中的HCl气体、浓硫酸;Cl2+2OH-=Cl-+ ClO-+2H2O;44.8;
(3)次氯酸钠有强氧化性,在酸性条件下可以将盐酸氧化生成氯气,离子方程式为:Cl-+ ClO-+2H+= Cl2↑+H2O,故答案为:Cl-+ ClO-+2H+= Cl2↑+H2O。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下,Fe与水蒸气可发生反应。应用下列装置,就可以完成此反应的实验。

(1)仪器A的名称为____________;其底部放了几片碎瓷片,其作用是____________。
(2)实验前必须对整套装置进行的操作是_________________;实验开始时应先点燃_____(填“酒精灯”或“酒精喷灯”)。
(3)若反应生成的固体具有磁性,写出铁与水蒸气反应的化学方程式__________________。
(4)请写出在D处收集尾气的方法:___________________________;如果要在D处点燃尾气,则必须对该气体进行____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:
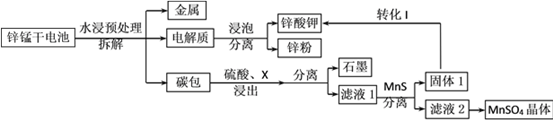
已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;
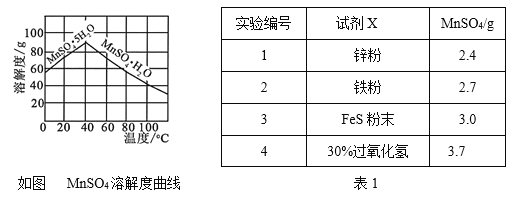
⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
(2)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。
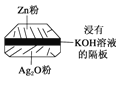
根据上述反应式,完成下列题目。
(1)下列叙述正确的是________。
A.在使用过程中,电解质KOH被不断消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________________________________________________________。
(3)使用时,负极区的pH________(填“增大”“减小”或“不变”,下同),正极区的pH______,电解质溶液的pH________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时,立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D 的分子式分别为:
A_______________ B_______________C_______________D_______________
(2)写出下列各反应的化学方程式:
A与B______________________________________________
B与水____________________________________________
C与澄清石灰水______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
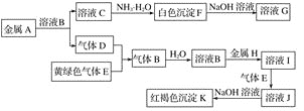
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
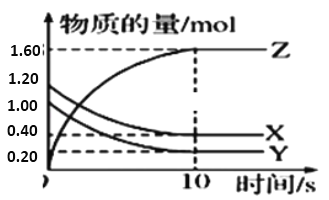
(1)该反应的化学方程式为_____。
(2)从反应开始到10s时,用Y表示的反应速率为________,X的转化率为_____ 。
(3)10s时,该反应 ___ 达到了化学平衡状态。(填“是”或“否”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com