
分析 设生成的氯化钠的质量是x
NaOH+HCl═NaCl+H2O
40 36.5 58.5
40%×20g 7.3g 11.7g,
根据溶解度计算饱和溶液的质量分数,进而计算所得饱和溶液的质量,求出盐酸溶液的质量以及加入盐酸的质量分数结合质量分数和浓度关系公式c=$\frac{1000ρw%}{M}$来计算.
解答 解:设生成的氯化钠的质量是x
NaOH+HCl═NaCl+H2O
40 36.5 58.5
40%×20g 7.3g 11.7g,
所以所得饱和溶液的质量为:$\frac{\frac{11.7g}{35.1g}}{135.1g}$=45g,则盐酸的质量为:45g-20g=25g,加入盐酸的质量分数为=$\frac{7.3g}{25g}$×100=29.2%,该盐酸的物质的量浓度=$\frac{1000×1×29.2%}{36.5}$mol/L=8mol/L.
答:该盐酸的物质的量浓度是8mol/L.
点评 本题考查质量分数有关计算和根据化学方程式的计算,较好考查学生分析计算能力,难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )| A. | ① | B. | ①③ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1HNO3溶液50mL | B. | 0.6mol•L-1A12(SO4)3溶液35 mL | ||
| C. | 1.8mol•L-1NaCl溶液70ml | D. | 0.7mol•L-1 FeC13溶液60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
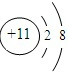 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
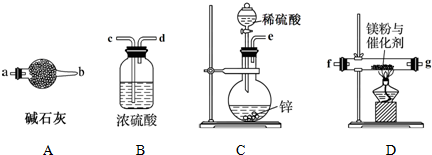
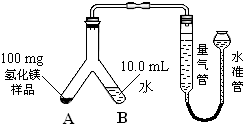
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 现象①③说明物质燃烧需要达到一定的温度 | |
| B. | 现象②③说明物质燃烧需要氧气 | |
| C. | 现象①②说明白磷的着火点比红磷的着火点低 | |
| D. | 现象②说明红磷不是可燃物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com