
【题目】(14分)用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
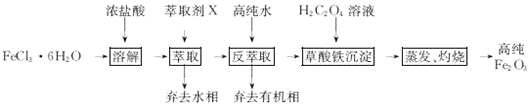
已知:HCl(浓)+FeCl3![]() HFeCl4
HFeCl4
试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca、Mn、Cu等杂质离子几乎都在 (填“水”或“有机”)相。
②若实验时共用萃取剂X 120 mL,萃取率最高的方法是 (填字母)。
a.一次性萃取,120 mL
b.分2次萃取,每次60 mL
c.分3次萃取,每次40 mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是 (写化学式);反萃取能发生的原因是 。
(3)所得草酸铁沉淀需用冰水洗涤,其目的是 。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式,并用单线桥标出电子转移的方向和数目 。
【答案】(14分,每空2分)(1)水 ,c ; (2)FeCl3,加高纯水时,酸度降低,平衡向转化为FeCl3的方向移动
(3)除去杂质、减少草酸铁晶体的溶解损耗
(4)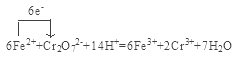 (4分)
(4分)
【解析】
试题(1)用萃取剂X萃取,该步骤中:①Ca、Mn、Cu等杂质离子都容易溶于水,而难溶于有机物,所以这些离子几乎都在水相中;②若实验时共用萃取剂X 120 mL,萃取率最高的方法是少量多次,故应该是分3次萃取,每次40 mL,选项是C;(2)用高纯水反萃取,萃取后水相中铁的存在形式是FeCl3,反萃取能发生的原因是加高纯水时,酸度降低,平衡向转化为FeCl3的方向移动;(3)所得草酸铁沉淀需用冰水洗涤,其目的是既除去了杂质,又减少草酸铁晶体的溶解损耗;(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,根据电子守恒、电荷守恒及原子守恒可得该反应的方程式,用单线桥标出电子转移的方向和数目是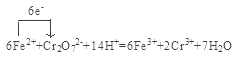 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________。
(3)滤渣1和滤渣3主要成分的化学式分别是________________,_____________。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________。
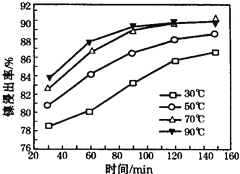
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm之间的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀地分散入蒸馏水中,得到的物质()
①是溶液 ②是胶体 ③具有丁达尔效应 ④能透过滤纸 ⑤静置会立即形成沉淀
A.②③④B.②③⑤C.①④⑤D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。

(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、CO32﹣、SO42﹣、Cl﹣,现取三份100mL溶液进行如下实验:根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量KOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
A. Na+一定存在
B. 100mL溶液中含0.01mol CO32﹣
C. Cl﹣一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的( )
A. 次氯酸钠溶液中通入少量二氧化硫气体:2ClO﹣+SO2+H2O═2HClO+SO ![]()
B. 向NaAlO2溶液中通过量CO2:AlO ![]() +CO2+H2O═Al(OH)3↓+CO
+CO2+H2O═Al(OH)3↓+CO ![]()
C. 电路板腐蚀液中的反应:Cu+2Fe3+═2Fe2++Cu2+
D. 小苏打溶液与NaOH溶液混合:HCO ![]() +OH﹣═CO2↑+H2O
+OH﹣═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定温度下的某恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
A. 增加c(NO),平衡逆向移动,反应的化学平衡常数减小
B. 100s 内NO2的分解速率为8×10-3 mol/(L·s)
C. 反应达平衡时,吸收的热量为0.2Q
D. 其他条件不变时,若开始时n(NO2)为2.4 mol,则达到平衡后,c(O2)<c(NO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com