
【题目】甲酸、乙醛和葡萄糖组成的某混合物,其中氧的质量分数为15.3%,则氢的质量分数为
A.84.7%B.72.6%C.12.1 %D.6.05%
【答案】C
【解析】
甲酸为CH2O,乙醛为C2H4O,葡萄糖为C6H12O6,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氧元素的质量发生计算混合物中碳元素与氢元素的质量分数之和,再根据碳元素与氢元素质量关系计算。
甲酸为CH2O,乙醛为C2H4O,葡萄糖为C6H12O6,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氧元素的质量发生计算混合物中碳元素与氢元素的质量分数之和,混合物中氧的质量分数为15.3%,则混合物中碳元素与氢元素的质量分数之和为1-15.3%=84.7%,故混合物中氢元素的质量分数![]() ,故答案选C。
,故答案选C。


科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法正确的是
A.硫黄矿制备硫酸经历两步:S![]() SO3
SO3![]() H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.向溶液中加入BaCl2溶液后滴加硝酸,若产生不溶于硝酸的白色沉淀,则溶液必含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①CH3COONa溶液呈碱性,原因是____________________(用化学用语表达)。
②在CH3COONa溶液中,各个离子浓度大小关系为_________________________
③写出碳酸钠溶液中电荷守恒关系式_________________________________________
(2)已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应是________(填“吸热”或“放热”)反应。
②它若反应消耗24gC(s),则反应吸收的热量为___________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下表中数据:
CO2(g)+H2(g),得到下表中数据:
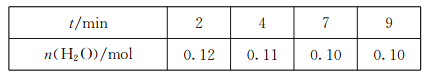
①2min内,v(CO)=________。
②该温度下,此反应的平衡常数的值是________。
③其他条件不变,再充入0.1molCO和0.molH2O(g),达到平衡时CO的体积分数_____(填“增大”“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极。请回答下列问题:
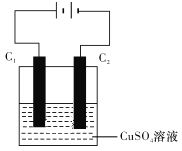
①C1作______(填“阳极”或“阴极”)。
②C2电极的电极反应式为___________。
③惰性电极电解CuSO4溶液的化学方程式是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示装置中加入一定量的铁粉,分液漏斗中加入一定体积浓度为12 mol·L-1的硝酸,加热打开分液漏斗的活塞,使其充分反应后,
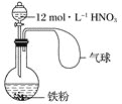
下列微粒:①![]() 、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
A.①B.①⑤C.②④⑤D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的aL氯化氢气体溶于100g水中,得到盐酸的密度为bg·mL-1,则该盐酸的物质的量浓度是______________________。
(2)向100mL的FeBr2溶液中通入标准状况下Cl23.36L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为__________________。
(3)FeCl3溶液可以用来净水,其净水的原理为___________________________(用离子方程式表示)。用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________(填“大于”“等于”或“小于”)0.2NA。
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-bmg/L,现用ClO2将CN-氧化,只生成两种无毒气体,其离子反应方程式为________________,处理100m3这种污水,至少需要ClO2____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烯烃、炔烃、苯的同系物、醇等有机物的叙述中正确的是( )
A.![]() 甲基
甲基![]() ,
,![]() 己二醇根据羟基数目分类应该属于二元醇
己二醇根据羟基数目分类应该属于二元醇
B.在苯的某种同系物中加入少量酸性高锰酸钾溶液振荡后溶液褪色是苯环和侧链相互影响的结果
C.![]() 分子结构中6个碳原子可能都在一条直线上
分子结构中6个碳原子可能都在一条直线上
D.![]() 月桂烯的结构如图所示
月桂烯的结构如图所示![]()
![]()
![]() ,该物质与等物质的量溴发生加成反应的产物
,该物质与等物质的量溴发生加成反应的产物![]() 不考虑立体异构
不考虑立体异构![]() 理论上最多有4种
理论上最多有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.将少量SO2气体通入过量氨水中:SO2+NH3·H2O=NH![]() +HSO
+HSO![]()
B.铝溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
C.用醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.用KIO3氧化酸性溶液中的KI:5I-+IO![]() +3H2O=3I2+6OH-
+3H2O=3I2+6OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com