
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
分析 CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,反应中Cu元素的化合价降低,I元素的化合价升高;向反应后的混合物中不断通入SO2气体,反应方程式为SO2+2H2O+I2=H2SO4+2HI,该反应中S元素的化合价升高,I元素的化合价降低,以此来解答,
解答 解:A.CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,由方程式可知当有2molI-参加反应,则生成1mol白色沉淀,故A正确;
B.通入SO2后溶液逐渐变成无色,发生了氧化还原反应,S元素的化合价升高,体现其还原性,故B错误;
C.通入SO2气体,反应方程式为SO2+2H2O+I2=H2SO4+2HI,该反应中S元素的化合价升高,则SO2为还原剂,生成H2SO4为氧化产物,I元素的化合价降低,则I2作氧化剂,故C错误;
D.还原剂的还原性强于还原产物的还原性,对于反应2CuSO4+4KI═2K2SO4+2CuI↓+I2,在这个方程中Cu2+化合价降低,是氧化剂,被还原为Cu+,I-化合价升高,是还原剂,物质的还原性:I->Cu+,SO2+2H2O+I2=H2SO4+2HI,I2化合价降低是氧化剂,被还原为I-,SO2 中的S化合价升高作还原剂,所以物质的还原性:SO2>I-,所以物质的还原性:SO2>I->Cu+,故D错误;
故选A.
点评 本题考查氧化还原反应,根据题目信息推断实验中发生的反应,素材陌生,难度较大,考查学生对氧化还原反应的利用,把握反应中元素的化合价变化为解答的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | Al2O3熔点高,可用作耐高温材料 | |
| C. | NH4HCO3受热易分解,可用作氮肥 | |
| D. | Al2(SO4)3易水解,可用于自来水的杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
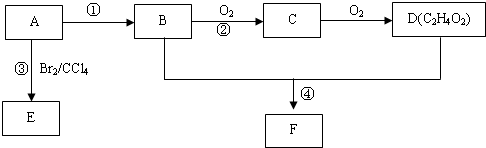
 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与稀硫酸反应生成氢气 | |
| B. | 铁与水反应生成氢氧化铁和氢气 | |
| C. | 钠投入CuSO4溶液中,可以置换出铜 | |
| D. | 某溶液与铝反应产生氢气,该溶液不一定是酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
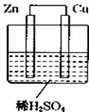 如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )| A. | ②④⑤ | B. | ②③④⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
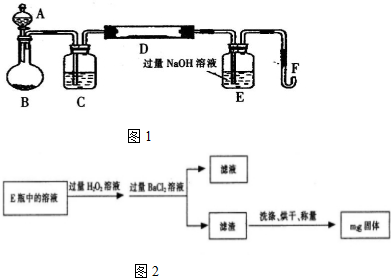
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④⑤ | B. | ②①④⑤③ | C. | ②④①⑤③ | D. | ④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ①②③⑥ | C. | ①②⑥⑦ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com