
【题目】FeCl2具有独有的脱色能力,适用于印染、造纸行业的污水处理。FeCl3在加热条件下遇水剧烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列问题:
(1)由FeCl3.6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3.6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后再加热,生成FeCl2。
①FeCl3.6H2O中加入SOCl2获得无水FeCl3的化学方程式为__________________。(已知该反应为非氧化还原反应)
②使用NH4SCN可以检验 ii中FeCl3是否含完全转化,请写出离子反应方程式_____________。
(2)利用反应2FeCl3 + C6H5Cl ![]() 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
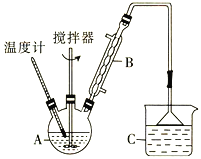
①仪器B的名称是_________ ;C的试剂名称是________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经______、_______、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是__________________________。
(3)粗产品中FeCl2的纯度测定。
①取a g粗产品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水至体积为200mL;③用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。若已知消耗酸性高锰酸钾溶液为VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的单位为g·L-1,则k=___________g·L-1·mL-1。
【答案】FeCl3.6H2O+6SOCl2![]() FeCl3+ 12HCl↑+6SO2↑ Fe3++3SCN-=Fe(SCN)3 或Fe3++SCN-=Fe(SCN)2+ (球形)冷凝管 水或氢氧化钠溶液 过滤 洗涤 装置B(或A)和C之间缺少一个装有无水氯化钙(P2O5或硅胶)的球形干燥管 12.7
FeCl3+ 12HCl↑+6SO2↑ Fe3++3SCN-=Fe(SCN)3 或Fe3++SCN-=Fe(SCN)2+ (球形)冷凝管 水或氢氧化钠溶液 过滤 洗涤 装置B(或A)和C之间缺少一个装有无水氯化钙(P2O5或硅胶)的球形干燥管 12.7
【解析】
(1)①SOCl2与水接触会迅速产生白雾和SO2,则FeCl3.6H2O中加入SOCl2获得无水FeCl3和HCl、SO2;
②Fe3+溶液中滴加含SCN-的溶液会变血红色;
(2)①根据仪器的结构和性能确定仪器的名称;C装置的作用是吸收挥发出的HCl气体;
②固液分离用过滤操作;
③FeCl3和FeCl2均易水解,要防止C中水蒸气进入A中;
(3)已知酸性条件下Fe2+被KMnO4溶液氧化时发生的离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL,则参加反应的MnO4-的物质的量为0.100 mol·L-1×V×10-3L=V×10-4mol,则ag粗产品中含有的Fe2+物质的量为V×10-4mol×5×![]() =V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,所配溶液的密度ρ(FeCl2)=kV计算k。
=V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,所配溶液的密度ρ(FeCl2)=kV计算k。
(1) ①SOCl2与水接触会迅速产生白雾和SO2,则FeCl3.6H2O中加入SOCl2获得无水FeCl3和HCl、SO2,则发生反应的化学方程式为6SOCl2+FeCl36H2O=FeCl3+12HCl↑+6SO2↑;
②利用NH4SCN检验溶液中是否含有Fe3+,判断FeCl3是否含完全转化,若不变红则完全转化,发生反应的离子方程式为Fe3++3SCN-=Fe(SCN)3 或Fe3++SCN-=Fe(SCN)2+;
(2)①由仪器的结构和性能可知:仪器B的名称是(球形)冷凝管;装置C中应盛装水或NaOH溶液吸收挥发的HCl气体;
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到FeCl2粗产品;
③该装置存在的不足之处是装置B(或A)和C之间缺少一个装有无水氯化钙(P2O5或硅胶)的球形干燥管,易造成C中水蒸气进入A中,促进FeCl3或FeCl2的水解;
(3)已知酸性条件下Fe2+被KMnO4溶液氧化时发生的离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL,则参加反应的MnO4-的物质的量为0.100 mol·L-1×V×10-3L=V×10-4mol,则ag粗产品中含有的Fe2+物质的量为V×10-4mol×5×![]() =V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,则所配溶液的密度ρ(FeCl2)=
=V×10-2mol,溶液中FeCl2的质量为V×10-2mol×127g/mol=1.27Vg,则所配溶液的密度ρ(FeCl2)=![]() =kV,解得k=12.7g·L-1·mL-1。
=kV,解得k=12.7g·L-1·mL-1。


科目:高中化学 来源: 题型:
【题目】某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
回答下列问题:
(1)正确操作步骤的顺序是(用字母序号填写)_________。
(2)排去碱式滴定管中气泡的方法应采用下图操作中的________(填标号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定过程中,眼睛应注视______________。
(4)判断到达滴定终点的实验现象是__________________。
(5)数据记录如下:
滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 20.00 | 0.40 | 20.50 |
第二次 | 20.00 | 4.10 | 24.00 |
第三次 | 20.00 | 1.00 | 24.00 |
根据上述数据,可计算出该盐酸的浓度约为_____________(保留小数点后两位数)。
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有_____(填字母)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管尖嘴部分有气泡,滴定后消失
D.滴定终点读数时俯视读数
E.滴定终点读数时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L。体积分别为![]() 和
和![]() 的HA溶液与BOH溶液按不同体积比混合,保持
的HA溶液与BOH溶液按不同体积比混合,保持![]() +
+![]() =100mL,
=100mL,![]() 、
、![]() 与混合溶液的pH的关系如图所示。下列说法正确的是( )
与混合溶液的pH的关系如图所示。下列说法正确的是( )
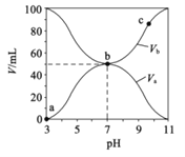
A.a→b过程中水的电离程度始终增大
B.![]() mol/L1
mol/L1
C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)
D.由图可知BOH一定是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
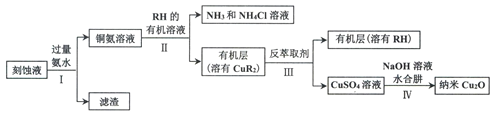
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g),反应过程中的能量变化如图所示,下列说法正确的是( )
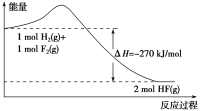
A.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量为270 kJ
B.氟化氢气体分解生成氢气和氟气的反应是放热反应
C.在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量
D.其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式___________________。
(2)13 g C2H2(g)完全燃烧生成CO2和H2O(l)时,放出659 kJ的热量,该反应的热化学方程式为 ___________________。
(3)2.3 g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7 g水和2.24 L CO2(标准状况),并放出68.35 kJ的热量,则该反应的热化学方程式为 ______________。
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”![]() 以下有关主族元素原子的“未成对电子”的说法,错误的是
以下有关主族元素原子的“未成对电子”的说法,错误的是![]()
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.原子轨道中含有“未成对电子”的基态原子,其核外电子数可能为偶数
D.原子轨道中不含“未成对电子”的基态原子,其核外电子数一定为偶数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚊虫、蚂蚁等叮咬人时,常向人体血液注入一种含有蚁酸(甲酸,HCOOH)的液体。
(1)写出甲酸在溶液中的电离方程式: ___________。
(2)当人受到蚂蚁叮咬时,皮肤上会起小疱,即使不治疗,过一段时间小疱也能自行痊愈,其原因为 ________。有同学认为,受到蚂蚁叮咬时及时涂抹稀氨水或肥皂水能起到治疗作用,这一观点________(填“正确”或“不正确”)。
(3)已知:25 ℃时,HCOOH的电离平衡常数K=1.8×10-4,H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11。下列说法正确的是(______)
A.向碳酸钠溶液中加入甲酸溶液看不到明显现象
B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K值均增大
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水,c(H+)增大
D.向碳酸中加入NaHCO3固体,溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
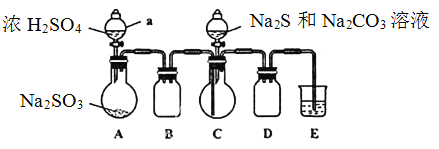
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com