
【题目】蚊虫、蚂蚁等叮咬人时,常向人体血液注入一种含有蚁酸(甲酸,HCOOH)的液体。
(1)写出甲酸在溶液中的电离方程式: ___________。
(2)当人受到蚂蚁叮咬时,皮肤上会起小疱,即使不治疗,过一段时间小疱也能自行痊愈,其原因为 ________。有同学认为,受到蚂蚁叮咬时及时涂抹稀氨水或肥皂水能起到治疗作用,这一观点________(填“正确”或“不正确”)。
(3)已知:25 ℃时,HCOOH的电离平衡常数K=1.8×10-4,H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11。下列说法正确的是(______)
A.向碳酸钠溶液中加入甲酸溶液看不到明显现象
B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K值均增大
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水,c(H+)增大
D.向碳酸中加入NaHCO3固体,溶液中c(H+)减小
【答案】HCOOH![]() HCOO-+H+ 叮咬初期,血液中的H+浓度增大,导致产生CO2而出现小疱,一段时间后血液又恢复酸碱平衡 正确 D
HCOO-+H+ 叮咬初期,血液中的H+浓度增大,导致产生CO2而出现小疱,一段时间后血液又恢复酸碱平衡 正确 D
【解析】
(1)甲酸是蚁酸,在溶液中存在电离平衡;
(2)根据甲酸的酸性比碳酸强,可以与血液中的HCO3-发生复分解反应分析,利用酸、碱中和反应判断;
(3)根据酸的电离平衡常数越大,酸性越强,利用强酸与弱酸的盐反应制取弱酸分析判断。
(1)甲酸是蚁酸,在溶液中存在电离平衡,电离方程式为:HCOOH![]() HCOO-+H+;
HCOO-+H+;
(2)甲酸是一种酸,会电离产生H+,叮咬初期,血液中的H+浓度增大,与血液中的HCO3-发生反应,产生甲酸盐、H2O、CO2,产生CO2而出现小疱,一段时间后血液又恢复酸碱平衡,过一段时间小疱也能自行痊愈;
受到蚂蚁叮咬时及时涂抹稀氨水或肥皂水,由于这些物质水溶液显碱性,会消耗蚂蚁叮咬释放的甲酸,降低H+的浓度,因此能起到治疗作用;
(3) A.由电离平衡常数可知:酸性HCOOH>H2CO3,所以向碳酸钠溶液中加入甲酸溶液,会发生复分解反应产生HCOONa、H2O、CO2,会看到产生气泡,A错误;
B.25 ℃时,向甲酸溶液中加入NaOH溶液,发生酸碱中和反应,甲酸的电离程度增大,但甲酸的电离平衡常数K值只与温度有关,温度不变,所以K不变,B错误;
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水,促进甲酸电离,但溶液中c(H+)总的来说是降低,C错误;
D.在碳酸溶液中存在电离平衡:H2CO3![]() H++HCO3-,向碳酸中加入NaHCO3固体,盐电离产生的HCO3-使溶液中c(HCO3-)增大,相当于增大了生成物的浓度,碳酸的电离平衡逆向移动,最终达到平衡时溶液中c(H+)减小,D正确;
H++HCO3-,向碳酸中加入NaHCO3固体,盐电离产生的HCO3-使溶液中c(HCO3-)增大,相当于增大了生成物的浓度,碳酸的电离平衡逆向移动,最终达到平衡时溶液中c(H+)减小,D正确;
故合理选项是D。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2具有独有的脱色能力,适用于印染、造纸行业的污水处理。FeCl3在加热条件下遇水剧烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列问题:
(1)由FeCl3.6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3.6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后再加热,生成FeCl2。
①FeCl3.6H2O中加入SOCl2获得无水FeCl3的化学方程式为__________________。(已知该反应为非氧化还原反应)
②使用NH4SCN可以检验 ii中FeCl3是否含完全转化,请写出离子反应方程式_____________。
(2)利用反应2FeCl3 + C6H5Cl ![]() 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
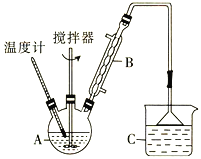
①仪器B的名称是_________ ;C的试剂名称是________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经______、_______、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是__________________________。
(3)粗产品中FeCl2的纯度测定。
①取a g粗产品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水至体积为200mL;③用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。若已知消耗酸性高锰酸钾溶液为VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的单位为g·L-1,则k=___________g·L-1·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )(已知:pH=-lgc(H+))
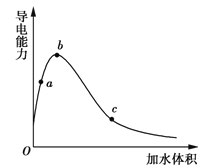
A.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
B.a、b、c三点溶液的pH:b<a<c
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和___________洗涤沉淀;检验沉淀中氯离子是否洗净的方法是___________。
(2)计算BaCl2·xH2O中的x=_________(要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果_________(填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤脱硫可减少SO2的排放,燃煤脱硫技术受到各界科研人员的关注。某种燃煤脱硫技术的原理为CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=-394.0 kJ·mol-1。保持其他条件不变,平衡时CO2的体积分数随起始CO物质的量的变化关系如图所示:
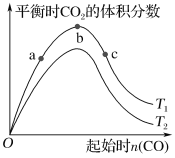
下列有关说法正确的是( )
A.T1>T2
B.T1时,b点对应状态的SO2转化率最高
C.T1时,b点后曲线下降是因为CO质量分数升高
D.减小压强可提高CO、SO2转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是
2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是

A.a、b两点的反应速率:b>a
B.T1>T2
C.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
D.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com