
【题目】燃煤脱硫可减少SO2的排放,燃煤脱硫技术受到各界科研人员的关注。某种燃煤脱硫技术的原理为CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=-394.0 kJ·mol-1。保持其他条件不变,平衡时CO2的体积分数随起始CO物质的量的变化关系如图所示:
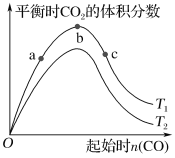
下列有关说法正确的是( )
A.T1>T2
B.T1时,b点对应状态的SO2转化率最高
C.T1时,b点后曲线下降是因为CO质量分数升高
D.减小压强可提高CO、SO2转化率
【答案】C
【解析】
A. CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=-394.0 kJ·mol-1,正反应是放热反应,升高温度,平衡逆向移动,二氧化碳的含量减少,所以由图可知T1<T2,A项错误;
B. 增加一种反应物的用量,可以提高另一种反应物的转化率,而本身的转化率降低,则CO的用量越多,二氧化硫的转化率越大,所以a点二氧化硫的转化率最低,而c点二氧化硫的转化率最高,B项错误;
C. 一氧化碳的物质的量增加,导致一氧化碳体积分数变大,二氧化碳的体积分数减小,所以b点后曲线下降是因为CO质量分数升高,C项正确;
D. CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g),正反应是气体体积减小的反应,所以减小压强,平衡逆向移动,则CO、SO2的转化率降低,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
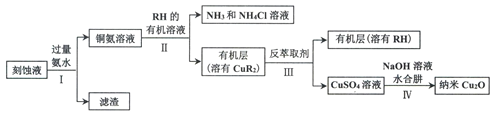
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚊虫、蚂蚁等叮咬人时,常向人体血液注入一种含有蚁酸(甲酸,HCOOH)的液体。
(1)写出甲酸在溶液中的电离方程式: ___________。
(2)当人受到蚂蚁叮咬时,皮肤上会起小疱,即使不治疗,过一段时间小疱也能自行痊愈,其原因为 ________。有同学认为,受到蚂蚁叮咬时及时涂抹稀氨水或肥皂水能起到治疗作用,这一观点________(填“正确”或“不正确”)。
(3)已知:25 ℃时,HCOOH的电离平衡常数K=1.8×10-4,H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11。下列说法正确的是(______)
A.向碳酸钠溶液中加入甲酸溶液看不到明显现象
B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K值均增大
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水,c(H+)增大
D.向碳酸中加入NaHCO3固体,溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. 混合气的平均分子量不再改变
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g)H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是________反应 (填“放热”或“吸热”);
(2)下列条件的改变能加快其反应速率的是_______(选填序号);
①升高温度;②保持体积不变,只增加CO的质量;③保持体积不变,充入Ne使体系压强增大;④保持压强不变,充入Ne使容器的体积增大
(3)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2,发生反应CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如下图所示:
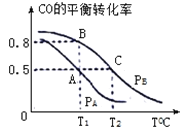
①A、B两点对应的压强大小关系是PA________PB;(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ____________;
③在P1压强、T1℃时,该反应的平衡常数K=___________;
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ____ v逆(填 >、< 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下的水溶液中,c(H+)和c(OH-)的关系如图所示:

(1)A点水的离子积为_____________,C点水的离子积为_____________,对纯水由25℃升高温度至100℃时水的离子积__________(填“增大”、“减小”或“不变”),各离子浓度由______点(填A、B、C、D)变为______点(填A、B、C、D)。
(2)100 ℃时,若向B点溶液中滴加硫酸,体系将由B点移向_____点(填C或D),为什么_____________________________________。
(3)25 ℃时,0.001mol/L的盐酸溶液pH=_______;0.001mol/L的氢氧化钠溶液pH=_________;若将二者温度都升高至100 ℃,________________(填“盐酸”、“氢氧化钠”或“盐酸和氢氧化钠”)的 pH会改变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
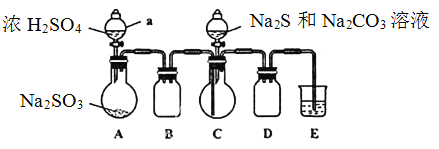
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。按要求回答:
(1)碳原子核外有________种不同空间运动状态的电子,第一电离能介于B和C之间的元素的名称为_________。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是_______________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
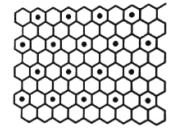
③石墨与钾可形成石墨夹层离子晶体C8K(如图),其结构为每隔一层碳原子插入一层钾原子,与钾原子层相邻的上下两层碳原子排列方式相同,则与钾最近等距的配位碳原子有_________个。
(3)碳也可形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
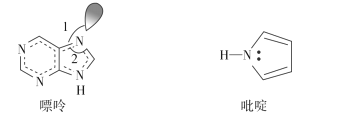
①1 mol 吡啶分子中含有σ键数目是__________。
②嘌呤结构中N原子的杂化方式为________。
③嘌呤中轨道之间的夹角∠1比∠2大,解释原因________________________________。
(4)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为ρ g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=________ pm (写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com