
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )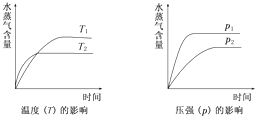
|
| A. | CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
|
| B. | CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
|
| C. | CH3CH2OH(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
|
| D. | 2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH═CH2(g)+2H2O(g);△H<0 |
| 反应热和焓变. . | |
| 专题: | 化学反应中的能量变化. |
| 分析: | 由图象可以看出,随着温度的升高,水蒸气的含量减小,说明升高温度平衡向逆反应方向移动,则正反应应为放热反应,增大压强,水蒸气的含量增大,说明增大压强平衡向正反应方向移动,则气体反应物的化学计量数之和大于气体生成物的化学计量数之和,以此解答该题. |
| 解答: | 解:温度越高,反应越快,到达平衡的时间就越少,因此t2>t1;同理压强越大,反应越快,到达平衡的时间就越少,因此p1>p2; A.反应是一个体积不变的、吸热的可逆反应,压强对水蒸气的含量不影响;升高温度平衡向正反应方向移动,增大水蒸气的含量,因此均不符合,故A错误; B.反应是一个体积减小的、放热的可逆反应,因此升高温度平衡向逆反应方向移动,降低水蒸气的含量;而增大压强平衡向正反应方向移动,增大水蒸气的含量,故B正确; C.反应是一个体积增大的、吸热的可逆反应,升高温度平衡向正反应方向移动,增大水蒸气的含量,不符合图象,故C错误; D.反应是一个体积增大的、放热的可逆反应,压强不符合,故D错误. 故选:B. |
| 点评: | 本题考查外界条件对化学平衡的影响及有关图象的分析和识别,题目难度中等,解答本题的关键是能正确分析温度、压强对平衡移动的影响. |


科目:高中化学 来源: 题型:
丙酮是一种有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是( )
A. 蒸发 B. 分液 C.过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A、高温下FeSO4发生如下反应:2FeSO4高温Fe2O3+SO2↑+SO3↑,将生成的气体通入氯化钡溶液中,得到的沉淀物是BaSO3和BaSO4
B、浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+
Fe(OH)2+2H+
若在此溶液中加入盐酸,则Fe2+浓度增大
C、在铁和铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1g;再向其中加入一定量的稀硫酸,充分振荡后 ,剩余金属m2g,则m1大于等于m2
D、实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的Na2CO3质量分别为1000mL , 212.0g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【[化学—有机化学基础】没食子酸丙酯简称PG,结构简式为 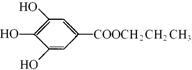 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
⑴PG的分子式为 ,请写出PG分子中所含官能团的名称 ,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是 。
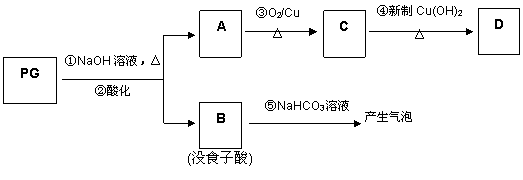 PG可发生如下转化:
PG可发生如下转化:
⑵A的结构简式为 ,1mol没食子酸最多可与 mol H2 加成。
⑶上图的有关变化中,属于氧化反应的有(填序号) 。
⑷从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号) 。
a.含有苯环 b.含有羧基 c.含有酚羟基 d. 微溶于食用油
⑸反应④的化学方程式为:
⑹B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:
i.含有苯环,且苯环上的一溴代物只有一种;ii.既能发生银镜反应,又能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属的冶炼,叙述错误的是( )
|
| A. | 活泼金属钠用电解法冶炼 | B. | 用火法或湿法均可制备铜 |
|
| C. | 金属镁只能用热还原法制备 | D. | 铁的冶炼可以用铝热法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
|
| B. | 合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
|
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
|
| D. | 对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
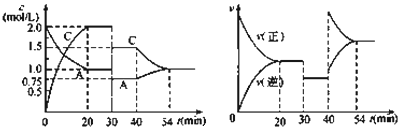
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )
|
| A. | 30 min~40 min间该反应使用了催化剂 |
|
| B. | 反应方程式中的x=1,正反应为吸热反应 |
|
| C. | 30~40min改变的条件是将容器的体积扩大至原来的2倍 |
|
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2的一些性质或用途如图,下列说法正确的是 ( )
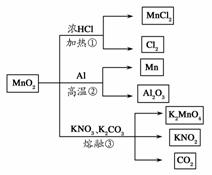
A.①、②、③三个反应中MnO2均作氧化剂
B.足量MnO2与2 L 10 mol/L HCl共热,可生成5 mol Cl2
C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D.反应③中K2CO3和KNO3的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)+I2(g)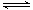 2HI(g);△H<0。有相同容积的定容密封容器甲和乙,甲中
2HI(g);△H<0。有相同容积的定容密封容器甲和乙,甲中
加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI
的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲不变,乙提高温度 B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D.甲增加0.1mol H2,乙增加0.1mol I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com