
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
|
| B. | 合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
|
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
|
| D. | 对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
| 化学平衡移动原理. . | |
| 专题: | 化学平衡专题. |
| 分析: | 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,且存在平衡移动,否则勒夏特列原理不适用. |
| 解答: | 解:A.加入硝酸银溶液后,生成AgBr沉淀,溴离子浓度减小,平衡向正方向移动,促进溴与水的反应,溶液颜色变浅,可用勒夏特列原理解释,故A不选; B.合成氨反应为放热反应,较低温度有利于平衡向正反应方向移动,可用勒夏特列原理解释,故B不选; C.正反应为放热反应,升高温度平衡向逆反应方向移动,体系颜色变深,可用勒夏特列原理解释,故C不选; D.对于2HI(g)═H2(g)+I2(g),因反应前后气体的体积不变,则压强对平衡移动无影响,不能用勒夏特列原理解释,故D选. 故选D. |
| 点评: | 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应且存在平衡移动,易错点为B,注意从提高产率的角度. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
胶体区别于其它分散系的本质特征是 ( )
A.胶体的分散质粒子能透过滤纸
B.胶体能产生丁达尔现象
C.胶体的分散质粒子直径在1~100 nm之间
D.胶体是纯净物,其它分散系是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
某炼铁废渣中含有大量的CuS及少量铁的氧化物,工业上以该废渣和NaCl为原料生产CuCl2·2H2O晶体,其工艺流程中主要涉及焙烧、尾气处理、酸浸、调控溶液pH、过滤、蒸发结晶等。焙烧过程中发生的主要反应为:CuS+2NaCl+2O2 = CuCl2+Na2SO4
请回答下列问题:
(1)若最后所得的滤液中的阴离子只有SO42—和Cl—,检验滤液中这两种离子的实验操作为: ______
。
(2)焙烧时还有废气SO2产生,若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是________ (填字母);若选用甲装置,则烧杯中的下层液体可以是_______ 。
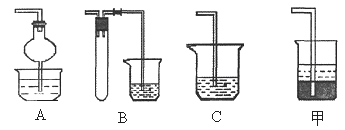 |
(3)回收SO2既能减少大气污染,又能充分利用资源。
①已知用Fe2+、Fe3+作催化剂,一定条件下在催化转化器中SO2能被O2氧化成SO42-,其中写以Fe3+为催化剂时的反应过程:
;4H++O2+4 Fe2+ === 4 Fe3+ + 2H2O
②目前国际上最先进的海水脱硫技术可对电厂尾气进行处理。这一技术的基本原理是:利用海水显弱碱性的特点,将含二氧化硫的尾气与海水、空气充分混和,最终使二氧化硫转换为硫酸盐并且不污染海水。流程图如下:
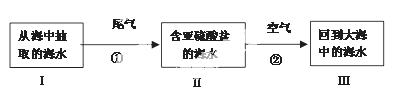
若海水I中主要阴离子为HCO3-,则反应①的离子方程式为 ;
反应②的离子方程式为 ;
检验海水Ⅲ中是否含有SO32- 所用的试剂为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1,推测含1mol HCl的稀溶液与含1mol NH3的稀溶液反应放出的热量( )
|
| A. | 小于57.3 kJ | B. | 等于57.3 kJ | C. | 大于57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )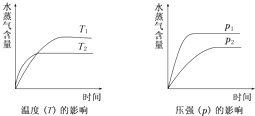
|
| A. | CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
|
| B. | CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
|
| C. | CH3CH2OH(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
|
| D. | 2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH═CH2(g)+2H2O(g);△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol•L﹣1,在一定条件下发生反应:A(g)+B(g)⇌2C(g),该温度下,此反应的平衡常数为4,则A的转化率为( )
|
| A. | 20% | B. | 30% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g•cm﹣3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
紫菜→(焙烧)→(浸取) (操作①)
(操作①) (操作②)→(蒸馏)→粗产品
(操作②)→(蒸馏)→粗产品
(1)实验室中焙烧紫菜用到的仪器有 CEF .
A.烧杯 B.蒸发皿 C.坩埚 D.试管 E.酒精灯 F.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式 2I﹣+H2O2+2H+═I2+2H2O .
(3)操作①的名称是 过滤 ;试剂A为 四氯化碳 (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
Ⅰ 乙醇与水互溶 ;
Ⅱ 裂化汽油能与碘发生加成反应 .
(4)操作②应在 分液漏斗 (仪器名称)中振荡、静置,操作时先分离出的是 下层液体 .
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离:
查看答案和解析>>
科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+□H2O。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)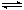 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。
下列说法错误的是
A.反应CO(g)+H2O(g)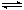 CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
B.在T2时,若反应进行到状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1< K2
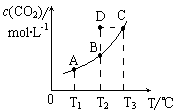
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com