
【题目】下列铝合金的性质与其用于国产C919飞机外壳无关的是( )
A. 导电性B. 密度小C. 抗腐蚀性强D. 硬度大
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
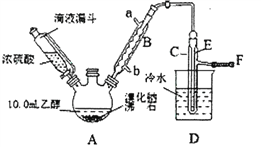
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其实验的装置如下(反应需要加热,图中省去了加热装罝):
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g cm-3) | 0.79 | 1.44 | 3. 1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是________。
(2)沸石的作用是________。
(3)己知H2SO4(浓)+NaBr![]() NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
(4)C中收集到的粗产品混有杂质的主要成份是________;为了除去这些杂质,最好选择下列____(选填序号)溶液来洗涤所得粗产品。
A.氢氧化钠B.碘化钠C.亚硫酸钠D.碳酸氢钠
(5)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的M固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。
①M固体的名称为________;
②在上述提纯过程中每次分液时,产品均从分液漏斗的________(填“上口”或“下口”)放出;
③从乙醇的角度考虑,本实验所得溴乙烷的产率是_________。
(6)该实验装罝的主要缺陷是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数, X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水, Z元素是地壳中含量最高的金属元素,W 的原子半径是第三周期中最小的。
(1)写出YX4+的电子式_______。
(2)写出Z与W所形成的盐与 YX3的水溶液反应的离子方程式________________。
(3)室温下,pH=3的XW溶液与pH=5的YX4W溶液中由水电离出的c(H+)的比为___。
(4)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0, 将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_____________________。
a.达到化学平衡时,任何一种物质表示的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中混合气体的平均相对分子质量减小
(5)有人设想寻求合适的催化剂和电极材料,以Y2、X2为电极反应物,以XW-YX4W 为电解质溶液制备新型燃料电池。请写出该电池的正极反应式_____________。
(6)汽车尾气中含有CO、NO、NO2等有毒气体,对汽车加装尾气净化装置,用含铂等过渡元素的催化剂催化,可使有毒气体相互反应转化成无毒气体。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2 (g) ΔH3=-393.5 kJ·mol-1
CO与NO2反应的热化学方程式为____________________,反应一定条件下可逆,温度不同(T2>T1二者均大于常温)、其他条件相同,下列图像正确的是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族.a的原子结构示意图为 ![]() ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为 ![]() ,则下列叙述中正确的是( )
,则下列叙述中正确的是( )
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>d
D.最高价氧化物对应的水化物的酸性:d>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中,不正确的是( )
A. SiO2可用作制备光导纤维
B. Na、K合金熔点比任何一个组分低
C. 通过化学反应可实现12C到14C的转化
D. 晶体硅可用于制作太阳能光板、制造芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号内为杂质),所用试剂和方法正确的是
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 溴乙烷(乙醇) | 乙酸、浓硫酸 | 蒸馏 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
D | 甲烷(丙烯) | 溴水 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组的同学拟用下图所示的装置从含碘废液(除H2O外,还有I2、I-等)中回收碘。回答下列问题:

(1)装置A中发生反应的离子方程式为________。
(2)仪器X的名称为________;装置D的作用是________。
(3)装置C中球形冷凝管冷却水从________(填“a”或“b”)进入,反应控制在较低温度下且保持溶液pH =2进行,其主要原因是________。
(4)三口烧瓶中液体经过滤得粗碘,粗碘可经________(填操作名称)得到纯碘。
(5)为测定某含碘废水中I2的含量,取样l00mL,调节溶液pH后,滴加2滴淀粉溶液,然后用0.02500mol/LNa2S2O3标准溶液滴定,消耗标准液18.15mL。则滴定终点时的现象为________,含碘废水中I2的含量=________mg/mL(结果保留小数点后三位,已知:I2 +2S2O32-=2I-+S4O62-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源。
(一)从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物:③将沉淀物与盐酸反应,结晶、过滤、干燥;④加热,将MgCl2·6H2O晶体转化为无水MgCl2⑤电解得到产物。
(1)以上提取镁的全过程中,没有涉及的化学反应类型是__________(填字母)
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)步骤中多次进行过滤,实验室进行过滤时用到的玻璃仪器主要有____________。
(3)某兴趣小组模拟步骤④设计下图装置进行实验,

该装置中A的作用是______________________________________。
(4)下列关于提取镁的说法中,正确的是__________(填字母)
A.此法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁 D.将氯气循环利用,可提高经济效益
(二)从海水中得到的某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。

(1)起始滤液的pH________7 (填“大于”、“小于”或“等于”),其原因是(用离子方程式表示)__________________________________。
(2)试剂Ⅱ的化学式为___________,②中加入试剂Ⅱ的目的是_______________;③中发生反应的离子方程式为____________________;
(3)某冋学称取提纯的产品0.6984g,溶解后定容在100mL容量瓶中,每次取25,00mL
溶液,用0.1000mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为22.50mL,该产品的纯度为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com