
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
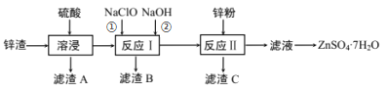
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
【答案】锌渣粉碎成粉末、适当提高温度、适当提高硫酸浓度、搅拌 PbSO4 Cu、(Zn) 2Fe2++ClO+2H+=2Fe3++Cl+H2O 3 除去锌粉表面的氧化膜 蒸发浓缩、冷却结晶、过滤洗涤 C
【解析】
氧化锌矿(主要成分为ZnO、FeO、CuO、PbO等)加稀硫酸溶解,过滤,滤渣A为难溶物硫酸铅,滤液中主要含有硫酸锌、硫酸铜、硫酸亚铁等;加NaClO氧化亚铁离子,加NaOH溶液生成氢氧化铁沉淀,过滤;此时滤液中含有硫酸铜、硫酸锌和硫酸钠,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液主要为硫酸锌和硫酸钠,经蒸发浓缩、冷却结晶、过滤洗涤得到ZnSO47H2O晶体,以此解答该题。
(1)锌渣粉碎成粉末、适当提高温度、适当提高硫酸浓度、搅拌等措施都可以加快“锌渣”“溶浸”速率;
(2)滤渣A为难溶物PbSO4;滤渣C为被置换出来的铜和过量的锌;
(3)“反应Ⅰ”中①,加入NaClO氧化亚铁离子生成铁离子,自身被还原成氯离子,根据电子守恒和元素守恒可得离子方程式为2Fe2++ClO+2H+=2Fe3++Cl+H2O;Ksp[Fe(OH)3]=c(Fe3+)·c3(OH),当c(Fe3+)=4×105mol·L-1时,c(OH)=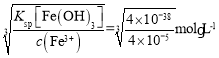 =10-11mol/L,所以溶液的pH值为3;
=10-11mol/L,所以溶液的pH值为3;
(4)锌粉为活泼金属,容易被空气氧化,形成氧化膜,稀硫酸可以除去锌粉表面的氧化膜;
(5)从溶液中获取晶体,一般需要经过蒸发浓缩、冷却结晶、过滤洗涤等步骤;
(6)28.70 g ZnSO47H2O的物质的量为0.1mol,由Zn元素守恒可知,可以生成0.1molZnSO4H2O或ZnSO4或ZnO,或![]() molZn3O(SO4)2;
molZn3O(SO4)2;
若得ZnSO4H2O的质量为17.90g(100℃);
若得ZnSO4的质量为16.10g(250℃);
若得Zn3O(SO4)2的质量约为13.43g(680℃);
若得ZnO的质量为8.10g(930℃);
综上所述答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下,H2 (g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的ΔH相同
2HCl(g)在光照和点燃条件下的ΔH相同
B. 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C. 已知:①2H2(g) +O2(g)![]() 2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)
2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)![]() 2H2O(l)ΔH=-b kJ·mol-1,则a>b
2H2O(l)ΔH=-b kJ·mol-1,则a>b
D. 已知:①C(s,石墨)+O2 (g)![]() CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)
CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)![]() CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)
CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)![]() C(s,金刚石)ΔH= -1.5 kJ·mol-1
C(s,金刚石)ΔH= -1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分![]() )提取
)提取![]() 的一种工艺流程如下:
的一种工艺流程如下:
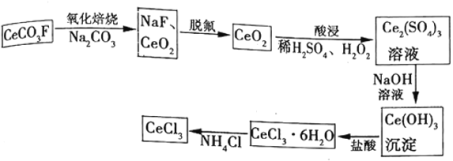
请回答下列问题:
(1)脱氟过程的实验操作是________,酸浸过程中加入![]() 的作用是________。
的作用是________。
(2)常温下,若溶液中的![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() 为________(己知
为________(己知![]() )。
)。
(3)准确称取![]() 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵![]() 溶液将
溶液将![]() 氧化为
氧化为![]() ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:![]() )
)
①已知:过二硫化酸的结构式为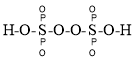 ,其中
,其中![]() 元素的化合价为________。
元素的化合价为________。
②该样品中![]() 的质量分数为________(精确到
的质量分数为________(精确到![]() )。
)。
③若使用久置的![]() 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该![]() 样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
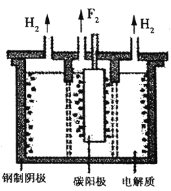
(4)脱氟过程中产生的![]() 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾![]() ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢![]() 混合物制备氟单质,电原理为
混合物制备氟单质,电原理为![]() 装置如图所示。已知
装置如图所示。已知![]() 是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活中有广泛应用。
(1)![]() 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向![]() 的铁屑中通入
的铁屑中通入![]() 生产无水
生产无水![]() 。已知:
。已知:![]() 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、![]() 左右时升华。
左右时升华。
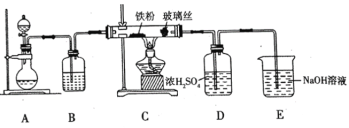
回答下列问题
①写出用高锰酸钾和浓盐酸在装置![]() 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置![]() 中加入的试剂是_____,装置
中加入的试剂是_____,装置![]() 中玻璃丝的作用是_____,
中玻璃丝的作用是_____,![]() 中
中![]() 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置![]() 前应除去其中含有的
前应除去其中含有的![]() ,改进措施为_____。
,改进措施为_____。
(2)一种新型高效净水剂![]() (聚合氯化铁铝
(聚合氯化铁铝![]() ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取![]() ,设计生产流程如下:
,设计生产流程如下:
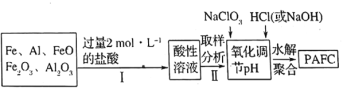
①实验室现需用![]() 的稀盐酸,欲用
的稀盐酸,欲用![]() 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
②![]() 中
中![]() 显________价,
显________价,![]() 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中![]() 与
与![]() 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中![]() 的含量,以确定加入
的含量,以确定加入![]() 的量 D.测定溶液中
的量 D.测定溶液中![]() 的含量
的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
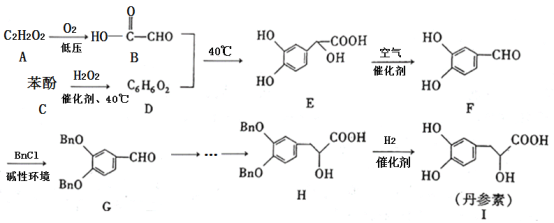
已知:![]() 代表苄基(
代表苄基(![]() )
)
请回答下列问题:
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中所含官能团的名称为羟基、______。
中所含官能团的名称为羟基、______。
(2)![]() 的反应类型为_______,该反应的目的是________。
的反应类型为_______,该反应的目的是________。
(3)写出![]() 的化学方程式:________。
的化学方程式:________。
(4)苯酚与![]() 反应可以制备物质
反应可以制备物质![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相对分子质量比
的同系物,相对分子质量比![]() 大14。则符合下列条件的
大14。则符合下列条件的![]() 的同分异构体有______种(不考虑立体异构)。
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与![]() 溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为________(写出一种即可)。
的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(s)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0
D. 其他条件不变,增大压强,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
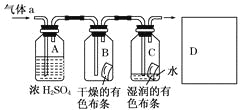
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com