
【题目】铁及其化合物在生产生活中有广泛应用。
(1)![]() 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向![]() 的铁屑中通入
的铁屑中通入![]() 生产无水
生产无水![]() 。已知:
。已知:![]() 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、![]() 左右时升华。
左右时升华。
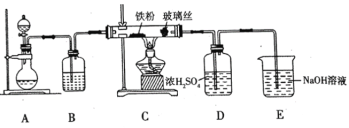
回答下列问题
①写出用高锰酸钾和浓盐酸在装置![]() 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置![]() 中加入的试剂是_____,装置
中加入的试剂是_____,装置![]() 中玻璃丝的作用是_____,
中玻璃丝的作用是_____,![]() 中
中![]() 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置![]() 前应除去其中含有的
前应除去其中含有的![]() ,改进措施为_____。
,改进措施为_____。
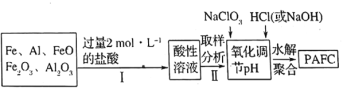
(2)一种新型高效净水剂![]() (聚合氯化铁铝
(聚合氯化铁铝![]() ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取![]() ,设计生产流程如下:
,设计生产流程如下:
①实验室现需用![]() 的稀盐酸,欲用
的稀盐酸,欲用![]() 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
②![]() 中
中![]() 显________价,
显________价,![]() 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中![]() 与
与![]() 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中![]() 的含量,以确定加入
的含量,以确定加入![]() 的量 D.测定溶液中
的量 D.测定溶液中![]() 的含量
的含量
【答案】![]() 浓硫酸 防止堵塞导管 除去过量氯气,防止其污染空气 在装置A、B之间连接盛有饱和食盐水的洗气瓶 50mL +3 不能 C
浓硫酸 防止堵塞导管 除去过量氯气,防止其污染空气 在装置A、B之间连接盛有饱和食盐水的洗气瓶 50mL +3 不能 C
【解析】
(1)根据题干信息可知实验目的为制备无水FeCl3,装置A为制备Cl2的装置,装置B为气体的干燥装置,C装置为Cl2和铁屑在500-600℃时反应生成FeCl3,D装置中的浓硫酸可吸收水蒸气,防止E中的水蒸气进入C装置中,E为尾气处理装置,据此分析解答;
(2)结合溶液稀释的规律进行相关计算,根据生产流程分析可知,工业生产废料加入过量的盐酸溶解后生成Fe2+、Fe3+和Al3+,取样分析后加入NaClO3将Fe2+氧化为Fe3+,加入HCl(或NaOH)调节pH水解聚合得到PAFC,据此分析解答。
(1)①装置A用高锰酸钾和浓盐酸制备氯气时,HCl被氧化为Cl2,高锰酸钾被还原为MnCl2,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②装置B为气体的干燥装置,Cl2为酸性气体,可用浓硫酸干燥,由于FeCl3在100℃左右时升华,则装置C中玻璃丝的作用为防止堵塞导管,E为尾气处理装置,NaOH可吸收过量的Cl2,防止其污染空气,故答案为:浓硫酸;防止堵塞导管;除去过量氯气,防止其污染空气;
③浓盐酸易挥发,生成的Cl2中混有挥发的HCl气体,热铁屑与HCl反应会生成无水FeCl2,使得制备的无水FeCl3不纯,因此可在装置A、B之间连接盛有饱和食盐水的洗气瓶,除去Cl2中含有的HCl气体,故答案为:装置A、B之间连接盛有饱和食盐水的洗气瓶;
(2)①根据公式c稀×V稀=c浓×V浓可得,c稀HCl×V稀HCl=c浓HCl×V浓HCl,由于实验室中没有200mL的容量瓶,因此选用250mL的容量瓶配制2mol/L的稀盐酸,则![]() ,故答案为:50mL;
,故答案为:50mL;
②由上述分析可知,NaClO3将Fe2+氧化为Fe3+,加入HCl(或NaOH)调节pH水解聚合得到PAFC,因此PAFC中Fe显+3价,PAFC在强酸性或强碱性溶液中均不能稳定存在,故答案为:+3;不能;
③在氧化之前,可测定溶液中Fe2+的含量,以确定加入NaClO3的量,C选项符合题意,故答案为:C。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭气化作为洁净煤利用的核心技术,是影响煤化工系统效率、污染物及温室气体排放的关键。工业生产中主要的气化方式包括纯水气化、CO2气化和纯氧气化,反应如下:
i.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
iii.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-123kJ·mol-1
CO(g) ΔH=-123kJ·mol-1
iv.C(s)+ O2(g)![]() CO2(g) ΔH=-409kJ·mol-1
CO2(g) ΔH=-409kJ·mol-1
(1)均相水煤气反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的ΔH__。
H2(g)+CO2(g)的ΔH__。
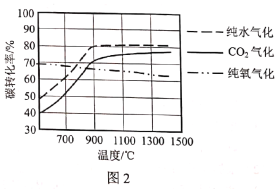
(2)图1是不同气化方式得到的合成气成分,图2是温度对碳转化率的影响(碳转化率是指气化得到气体中的碳占入炉原料煤中碳的质量分数)。
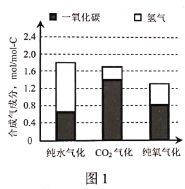
①气化过程中不同氧化剂的配比会对合成气的成分造成很大影响,为了提高合成气的氢碳比,生产中应该适当提高__在氧化剂中的比例。
②若使用混合氧化剂进行气化,最佳气化温度是___℃。温度升高纯氧气化的碳转化率降低,原因是___。
③工业上常在压强200kPa的条件下进行气化,压强过高过低都不利于气化的进行,可能的原因是__。
④T℃时,向容积可变的恒压密闭容器中加入20g燃煤(含碳84%)和2molH2O(g)模拟纯水气化反应,起始容积为2L。一段时间达到平衡后,测得容器内H2为1mol。则该温度下C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数K=__。
CO(g)+H2(g)的平衡常数K=__。
(3)煤的气化中可以利用CO2捕集技术实现CO2的综合利用。用石墨电极电解CO2制CH3CH2OH的原理示意图如图:
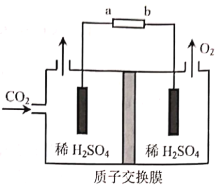
①b为电源的___(填“正”或“负”)极。
②生成CH3CH2OH的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了测定铜铁合金中铁的质量分数,现取铜铁合金样品20.0 g,将80.0 g稀硫酸平均分成4份,分4次逐渐加入到样品中,每次充分反应后测得剩余固体质量见下表
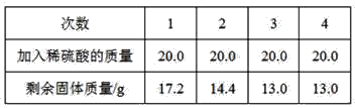
试求:
(1)20.0 g铜铁合金中,铜的质量是______。
(2)铜铁合金中,铁元素的质量分数是______。
(3)20 g稀硫酸溶液中溶质质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
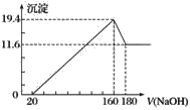
(1)合金中镁的质量是__________。
(2)所用盐酸的物质的量浓度是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A. 4 mo1SO2和2mol O2
B. 4mol SO2、2mo1 O2和2mol SO3
C. 4mol SO2.和4 mo1 O2
D. 6mo1 SO2和4 mo1 O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
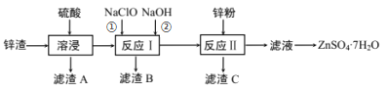
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,研究和开发碳的氧化物的应用对发展低碳经济,构建生态文明社会具有重要的意义。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为_____________。
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与![]() 的关系如图所示:
的关系如图所示:
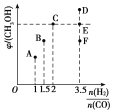
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当![]() =3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为________。(保留小数点后一位小数)
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:
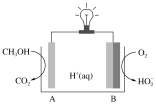
①外电路中每转移3mol电子,溶液中生成_______molH+
②写出电极B的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1<ΔH3 C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2>ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com