
【题目】酯类是工业上重要的有机原料,具有广泛用途。乙酸苯甲酯![]() 对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
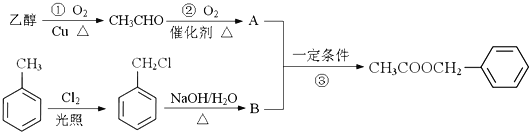
已知:R-Cl![]() R-OH,R-为烃基
R-OH,R-为烃基
(1)乙酸苯甲酯的分子式是________,B所含官能团的名称是________。
(2)写出反应③的化学反应方程式:________。反应①的反应类型是__________,反应③的反应类型是________________。
(3)下列转化中________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
A.乙醇制取乙醛 B.由![]() 制备
制备 C.2CH3CHO+O2
C.2CH3CHO+O2![]() 2A
2A
(4)提纯乙酸苯甲酯的有关实验步骤如下:将反应液冷至室温后倒入分液漏斗中,分别用饱和碳酸钠溶液和水洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏,收集馏分,得到乙酸苯甲酯。
回答下列问题:
①在洗涤、分液操作中。应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸苯甲酯从分液漏斗上口倒出
b.直按将乙酸苯甲酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸苯甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸苯甲酯从上口放出
②实验中加入少量无水MgSO4的目的是__________________。
③在蒸馏操作中,仪器选择及安装都正确的是____________(填标号)。
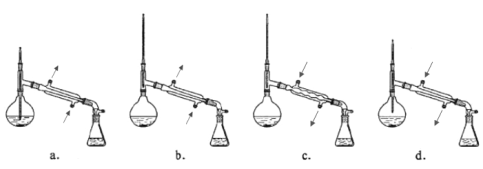
(注:箭头方向表示水流方向)
【答案】C9H10O2羟基CH3COOH +![]()
![]()
![]() + H2O氧化反应酯化反应(或取代反应)Cd干燥b
+ H2O氧化反应酯化反应(或取代反应)Cd干燥b
【解析】
乙醇发生催化氧化生成乙醛,乙醛进一步发生氧化反应生成A为CH3COOH,甲苯与氯气发生取代反应生成![]() ,发生水解反应生成B为
,发生水解反应生成B为![]() ,乙酸与苯甲醇发生酯化反应得到乙酸苯甲酯,据此解答。
,乙酸与苯甲醇发生酯化反应得到乙酸苯甲酯,据此解答。
(1)根据乙酸苯甲酯的结构简式可知其分子式是C9H10O2;根据以上分析可知B为![]() ,含有官能团为羟基;
,含有官能团为羟基;
(2)反应③是酯化反应,反应的化学反应方程式为CH3COOH+![]()
![]()
![]() +H2O。反应①是乙醇的催化氧化;
+H2O。反应①是乙醇的催化氧化;
(3)A.乙醇制取乙醛,有水生成,原子的理论利用率不是100%,A不符合;B.甲苯制备![]() ,有HCl生成,原子的理论利用率不是100%,B不符合;C.反应2CH3CHO+O2
,有HCl生成,原子的理论利用率不是100%,B不符合;C.反应2CH3CHO+O2![]() 2CH3COOH中生成物只有乙酸,原子的理论利用率为100%,符合绿色化学的要求,C符合,答案为C;
2CH3COOH中生成物只有乙酸,原子的理论利用率为100%,符合绿色化学的要求,C符合,答案为C;
(4)①由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸苯甲酯从上口放出,所以正确的为d,答案选d;
②实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对乙酸苯甲酯进行干燥;
③在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b,答案选b。


科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
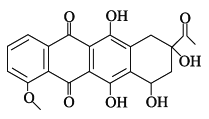
A. 每个柔红酮分子中含有 1 个手性碳原子(连有四个不同基团的碳原子)
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 一定条件下柔红酮可发生氧化、加成、消去反应
D. 1 mol 柔红酮最多可与 4 mol 氢溴酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据框图分析,下列说法不正确的是
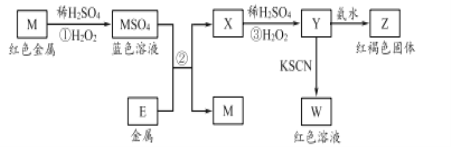
A. 我国是世界上最早使用反应②冶炼金属M的国家
B. M2+的氧化性比E2+的氧化性强
C. 在反应③中若不加稀硫酸,可能观察到红褐色沉淀
D. 在反应①中稀硫酸既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:
2A(g) + B(g)![]() 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
A.用物质A表示的反应速率为0.6mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质B的浓度为0.3mol/L
D.2s时物质A的转化率为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g)在温度和容积不变的条件下进行。能说明反应达到平衡状态的叙述是( )
2HI(g)在温度和容积不变的条件下进行。能说明反应达到平衡状态的叙述是( )
A. c(H2)=c(I2) B. H2的消耗速率等于HI的分解速率
C. 容器内气体的颜色不再变化 D. 容器内压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铑基催化剂催化CO加氢合成甲醇(CH3OH)、乙醛(CH3CHO)、乙醇等碳的含氧化合物是近年来化学界比较活跃的研究课题之一。
(1)已知:(ⅰ)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol
CH3OH(g) △H1=-90.1kJ/mol
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol
(ⅲ)C2H5OH(g)![]() CH3OCH3(g) △H3=+50.7kJ/mol
CH3OCH3(g) △H3=+50.7kJ/mol
则由CO催化加氢制备乙醇气体(另一产物为水蒸汽)的热化学反应方程式为________。
(2)直接甲醇燃料电池(DMFC)成本低、效率高,某研究所尝试用DMFC电解处理含氰电镀废水。调节废水pHl0~12.5,电解过程中,CNˉ先被氧化成CNOˉ(两种离子中氮元素均为-3价),再进一步氧化为碳酸盐和N2。
①请写出CNOˉ被氧化的电极反应式________。
②欲处理1m3CNˉ含量为390mg/L的电镀废水,至少需准备________kg甲醇。
(3)在2.0L密闭容器中放入1 molCO与2molH2,在反应温度T1时进行如下反应:
CO(g)+2H2(g)=CH3OH(g),反应时间(t)与容器内气体总物质的量(n)的数据见下表:
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
总物质的量n/mol | 3.0 | 2.7 | 2.5 | 2.3 | 2.1 | 2.0 | 2.0 |
①在0~5min时段,反应速率v(CH3OH)为________;有利于提高上述反应平衡转化率的条件是________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②计算温度T1时反应的平衡常数K1________;T1时达平衡后,改变反应温度为T2,平衡常数增大,则T2________T1(填“大于”“小于”),判断理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.晶体硅可用于制造光导纤维
B.氯氧化钠用来治疗胃酸过多
C.铝制容器可以用来贮运稀硝酸
D.乙烯用作水果的催熟剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com