
【题目】碳的化合物的转换在生产、生活中具有重要的应用,如航天员呼吸产生的CO2用Sabatier反应处理,实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g);
CH4(g)+2H2O(g);
水电解反应:2H2O(1) ![]() 2H2(g) +O2(g)。
2H2(g) +O2(g)。
(1)将原料气按n(CO2):n(H2)=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是_____。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. n(CO2):n(H2)=1:2
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算表达式为_______。(不必化简,用平衡分,压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化率的是____(填标号)。
A.适当减压 B.合理控制反应器中气体的流速
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
(3)一种新的循环利用方案是用Bosch反应CO2(g)+4H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
①已知CO2(g)、H2O(g)的生成焓分别为-394kJ/mol、-242kJ/mol,Bosch反应的△H=_____kJ/mol。(生成焓指一定条件下由对应单质生成lmol化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是______________。若使用催化剂,则在较低温度下就能启动。
③Bosch反应的优点是_______________。
【答案】 增大 BC ![]() BC -90 反应的活化能高 氢原子利用率为100%
BC -90 反应的活化能高 氢原子利用率为100%
【解析】①根据图中平衡时![]() 的物质的量分数曲线随温度的降低而增大,可知该正反应为放热反应,K随温度的升高而减小,K随温度降低而增大。答案:增大。
的物质的量分数曲线随温度的降低而增大,可知该正反应为放热反应,K随温度的升高而减小,K随温度降低而增大。答案:增大。
②根据在密闭恒温(高于100℃)恒容装置中进行的反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g);可知A.混合气体密度不会改变,所以不能作为平衡的依据,故A错;B.由反应可知此反应两边计量数不等,所以混合气体压强不再改变标志达到平衡,故B正确。C.混合气体平均摩尔质量M=m/n,M不变说明n不在改变,说明达到平衡了。故C正确; D. n(CO2):n(H2)=1:2不符合化学平衡的定义,不能作为判断平衡的依据,故D错。本题答案:B C。
CH4(g)+2H2O(g);可知A.混合气体密度不会改变,所以不能作为平衡的依据,故A错;B.由反应可知此反应两边计量数不等,所以混合气体压强不再改变标志达到平衡,故B正确。C.混合气体平均摩尔质量M=m/n,M不变说明n不在改变,说明达到平衡了。故C正确; D. n(CO2):n(H2)=1:2不符合化学平衡的定义,不能作为判断平衡的依据,故D错。本题答案:B C。
③在密闭容器里全部由气体参与的反应中,平衡时气体压强之比=气体物质的量之比=气体物质的量浓度之比。根据![]() 反应达到平衡时
反应达到平衡时![]() 的物质的量分数,可知平衡时
的物质的量分数,可知平衡时![]() 所占的压强为
所占的压强为![]() ,根据化学反应方程式可知
,根据化学反应方程式可知![]() 所占压强为
所占压强为![]() ,因此
,因此![]() 和
和![]() 所占的压强为
所占的压强为![]() 。根据初始投料比以及
。根据初始投料比以及![]() 和
和![]() 的化学计量数之比可知反应达到平衡时,两者的物质的量之比也为
的化学计量数之比可知反应达到平衡时,两者的物质的量之比也为![]() ,故平衡时
,故平衡时![]() 所占的压强为
所占的压强为![]() ,
,![]() 所占的压强为
所占的压强为![]() ,故可写出
,故可写出![]() 的表达式为
的表达式为![]() 。
。
(2)A项,该反应为气体分子数减小的反应,根据勒夏特列原理可知减压后反应向逆反应方向进行,会降低![]() 的转化效率,故A项错;B根据 CO2(g)+4H2(g)
的转化效率,故A项错;B根据 CO2(g)+4H2(g)![]() C(s)+2H2
C(s)+2H2![]() 的转化效率,故选C项;D项,提高原料气中
的转化效率,故选C项;D项,提高原料气中![]() 的比例会增大
的比例会增大![]() 的转化率,但会减小
的转化率,但会减小![]() 的转化效率,故D项错。综上所述,本题正确答案为BC。
的转化效率,故D项错。综上所述,本题正确答案为BC。
(3)①根据题目给出条件可知a.![]()
![]() ,b.
,b.![]()
![]() ,由
,由![]() 即可得Bosch反应,其反应热为
即可得Bosch反应,其反应热为![]() 。
。
②在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应。升高温度可以提高反应物的活化能,从而发生反应,而Bosch反应的反应活化能高,所以必须在高温下才能启动。
③在Bosch反应中,氢原子全部转化到水分子中,水电解后氢原子又重新全部形成![]() ,因此该方案的优点为氢原子利用率为
,因此该方案的优点为氢原子利用率为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)![]() 的水溶液呈_______(填“酸”“中”或“碱”)性,原因是_________________(用离子方程式表示);在实验室中配制
的水溶液呈_______(填“酸”“中”或“碱”)性,原因是_________________(用离子方程式表示);在实验室中配制![]() 溶液时,常先将
溶液时,常先将![]() 固体溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以_____(填“促进”或“抑制”)其水解。
固体溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以_____(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是_______________(用离子方程式表示),把![]() 溶液蒸干、灼烧,最后得到的主要固体产物是____________。
溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(3)泡沫灭火器的灭火原理是________________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氡(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O![]() NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
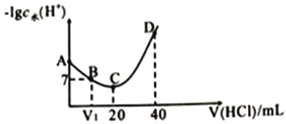
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等
B. A点对应溶液的pH=9.5
C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C点时,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。通过查阅资料,学习小组获知:FeCl3是一种共价化合物,熔点306℃,沸点315℃。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)现象i中的白雾是___________________,形成白雾的原因是________________。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。
通过该实验说明现象ii中黄色气体含有_______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
原因①:实验b检出的气体使之变蓝,反应的离子方程式是______________________________。
原因②:在酸性条件下,装置中的空气使之变蓝,反应的离子方程式是_______________。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试荆是____________________。
②方案2中检验Fe2+的试剂是____________________。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是_____________________。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂质(括号内物质为杂质)的方法中,错误的是
A. CH4(C2H4):酸性高锰酸钾溶液
B. NaHCO3溶液(少量Na2CO3):通入足量的CO2气体
C. 溴苯(混有Br2):加NaOH溶液洗涤、静置、分液
D. FeCl2溶液(FeCl3):加入过量铁,充分反应后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
(1)该反应的逆反应是________热反应,且m+n______(填“>”“<”或“=”)p。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、K+、Cl-、SO32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C. ![]() 的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+
D. 由水电离出的c(H+) =10-12mol/L的溶液:Na+、K+、CO32-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com