
【题目】下列中心原子采取sp2杂化且为非极性分子的是
A.CS2B.H2SC.SO2D.SO3
【答案】D
【解析】
原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子是非极性分子。分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,据此可以判断。
A、根据价层电子对互斥理论可知,CS2分子中碳原子含有的孤对电子对数=![]() =0,因此二硫化碳是直线型结构,属于非极性分子,碳原子是sp杂化,A不正确;
=0,因此二硫化碳是直线型结构,属于非极性分子,碳原子是sp杂化,A不正确;
B、H2S分子中S原子含有的孤对电子对数=![]() =2,因此H2S是V型结构,属于极性分子,S原子是sp3杂化,B不正确;
=2,因此H2S是V型结构,属于极性分子,S原子是sp3杂化,B不正确;
C、SO2分子中S原子含有的孤对电子对数=![]() =1,因此SO2是V型结构,属于极性分子,S原子是sp2杂化,C不正确;
=1,因此SO2是V型结构,属于极性分子,S原子是sp2杂化,C不正确;
D、三氧化硫分子中S原子含有的孤对电子对数=![]() =0,因此SO3是平面三角形结构,属于非极性分子,S原子是sp2杂化,D正确;
=0,因此SO3是平面三角形结构,属于非极性分子,S原子是sp2杂化,D正确;
答案选D。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铋片[主要成分(BiO)2CO3]可用于治疗慢性胃炎及缓解胃酸过多引起的胃病。由菱铋矿(主要成分为nBi2O3·mCO2·H2O,含杂质SiO2、CuS等)制备(BiO)2CO3的一种工艺如图:
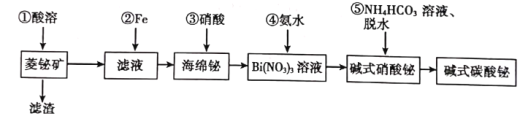
试回答下列问题:
(1)为提高①的“酸溶”速率,可以采取的措施是__________(任写一种)。
(2)①中酸溶解率与接触时间及溶液的pH之间的关系如图,据此分析,“酸溶”的最佳条件为__________;滤渣的主要成分是__________。
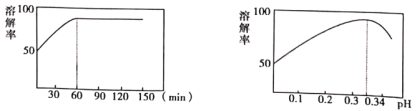
(3)“酸溶”后溶液必须保持强酸性,以防止铋元素流失,原理是__________。
(4)②中得到“海绵铋”的离子方程式为__________。
(5)④中反应的化学反应方程式为__________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Cu2+、Bi3+的混合溶液中滴加Na2S溶液,当Fe2+恰好沉淀完全时,所得溶液c(Cu2+):c(Bi3+)=__________。(忽略Na2S溶液所带来的体积变化)。
资料:①有关溶度积数据见表:
难溶物质 | FeS | CuS | Bi2S3 |
Ksp(25℃) | 6.3×10-18 | 6.3×10-36 | 1.6×10-20 |
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的电负性由小到大的顺序为________________。
(2)C的最高价氧化物分子是________(填“极性”或“非极性”)分子。
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①_______________②_______________
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为____;E(CO)5在一定条件下发生分解反应:E(CO)5===E(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是________________。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的: ______
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:① ______ ;② ______ ![]() 请填写两件主要的玻璃仪器
请填写两件主要的玻璃仪器![]()
(3)实验内容:
序号 | 实验方案 | 实验现象 |
① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
(4)实验结论: ______ .
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因. ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LHF中含有的极性键数目为0.1NA
B.18g重氢氨基(-ND2)中含有的电子数为10NA
C.33.6L氯气与足量铝充分反应,转移电子数为3NA
D.7g乙烯和丙烯混合气体中的氢原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品防腐剂R的结构简式如图所示: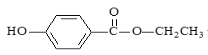 ,下列说法正确的是
,下列说法正确的是
A.R在空气中易被氧化且易溶于水
B.1个R分子最多有20个原子共平面
C.能与FeCl3发生显色反应,苯环有2个取代基,且能发生水解反应R的同分异构体有18种(包括R)
D.1molR与3molH2反应生成的有机物分子式为C9H18O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法不正确的是( )
A. 萃取![]() 时,向盛有溴水的分液漏斗中加入
时,向盛有溴水的分液漏斗中加入![]() ,振荡、静置分层后,打开旋塞,先将水层放出
,振荡、静置分层后,打开旋塞,先将水层放出
B. 做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色
C. 乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞
D. 可用![]() 溶液和稀
溶液和稀![]() 区分
区分![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 氧化
氧化![]() 制
制![]() 对资源综合利用有重要意义。相关的主要化学反应有:
对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ ![]()
![]()
Ⅱ ![]()
![]()
Ⅲ ![]()
![]()
Ⅳ ![]()
![]()
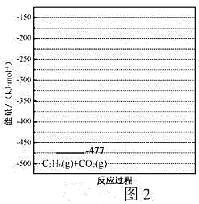
已知:![]() 时,相关物质的相对能量(如图1)。
时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的![]() (
(![]() 随温度变化可忽略)。例如:
随温度变化可忽略)。例如: ![]()
![]() 。
。
请回答:
(1)①根据相关物质的相对能量计算![]() _____
_____![]() 。
。
②下列描述正确的是_____
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:![]()
![]()
![]() ,且第二步速率较慢(反应活化能为
,且第二步速率较慢(反应活化能为![]() )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从![]() 的能量
的能量![]() ,开始(如图2)_____
,开始(如图2)_____
。
(2)①![]() 和
和![]() 按物质的量1:1投料,在
按物质的量1:1投料,在![]() 和保持总压恒定的条件下,研究催化剂X对“
和保持总压恒定的条件下,研究催化剂X对“![]() 氧化
氧化![]() 制
制![]() ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表:
催化剂 | 转化率 | 转化率 | 产率 |
催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,![]() 氧化
氧化![]() 的主要产物是______,判断依据是_______。
的主要产物是______,判断依据是_______。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高![]() 的选择性(生成
的选择性(生成![]() 的物质的量与消耗
的物质的量与消耗![]() 的物质的量之比)。在
的物质的量之比)。在![]() ,乙烷平衡转化率为
,乙烷平衡转化率为![]() ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到
,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到![]() 。结合具体反应说明乙烷转化率增大的原因是_____。
。结合具体反应说明乙烷转化率增大的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com