
����Ŀ��A��B��C��D��E����5��Ԫ�أ�����գ�
��1��AԪ�ػ�̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӣ���Ԫ�ط���Ϊ______
��2��BԪ�صĸ�һ�����Ӻ�CԪ�ص���һ�����ӵĵ��Ӳ�ṹ�������ͬ��B��һ�����ӵĽṹʾ��ͼΪ______��C�ĵ����Ų�ʽΪ______
��3��DԪ�ص����������ӵ�3d�Dz�Ϊ�������D��Ԫ�ط���Ϊ___�����̬ԭ�ӵĵ����Ų�ʽΪ______��
��4��EԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ�E��Ԫ�ط���Ϊ____�����̬ԭ�ӵĵ����Ų�ʽΪ______��
���𰸡� N ![]() 1s22s22p63s23p64s1 Fe 1s22s22p63s23p63d64s2��[Ar]3d64s2 Cu 1s22s22p63s23p63d104s1��[Ar]3d104s1
1s22s22p63s23p64s1 Fe 1s22s22p63s23p63d64s2��[Ar]3d64s2 Cu 1s22s22p63s23p63d104s1��[Ar]3d104s1
����������1��AԪ�ػ�̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӣ����Ԫ��Ϊ��Ԫ�أ���Ԫ�ط���ΪN��
��2��BԪ�صĸ�һ�����Ӻ�CԪ�ص���һ�����ӵĵ��Ӳ�ṹ�������ͬ����BΪ��Ԫ�ء�CΪ��Ԫ�ء�B��һ�����ӵĽṹʾ��ͼΪ![]() ��C�ĵ����Ų�ʽΪ1s22s22p63s23p64s1��
��C�ĵ����Ų�ʽΪ1s22s22p63s23p64s1��
��3��DԪ�ص����������ӵ�3d�Dz�Ϊ���������DΪ��Ԫ�أ���Ԫ�ط���ΪFe�����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d64s2��[Ar]3d64s2��
��4��EԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ���EΪͭԪ�أ���Ԫ�ط���ΪCu�����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1774�꣬��仯ѧ���������о����̿���Ҫ�ɷ���MnO2���Ĺ����У�������Ũ�����ϼ��ȣ���������ɫ���壬��Ӧ�Ļ�ѧ����ʽΪMnO2��4HCl��Ũ��![]() MnCl2��Cl2����2H2O��
MnCl2��Cl2����2H2O��
��1����Ӧ����������______���ѧʽ������Ԫ�صĻ��ϼ�______������ߡ����͡�����
��2����������1 mol MnO2�������ɱ�״����Cl2�������______L��ת�Ƶ��ӵ����ʵ�����______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ-ѡ��3:���ʽṹ�����ʡ�
��֪A��B��C��D��E����Ԫ�ص�ԭ������������������Aԭ����������������������������ԭ��������ȣ�Bԭ�Ӻ������s�����������p�����������������Dԭ��L������2�ԳɶԵ��ӣ�E2+ԭ�Ӻ�����3�������M��3d������Ӱ�������ش���������:
(1)AԪ��λ�����ڱ�_____����CD3-�Ŀտɹ���Ϊ_____������Cԭ�ӵ��ӻ���ʽΪ______��
(2)��һ������C>D��ԭ����__________________��
(3)���б�������֤��DԪ�رȷ�Ԫ�ص縺������һ��ʵ����______��
A.�����·�������ɫ��D���ʵ���ɫ��
B. ������D���⻯����ҷ�Ӧ������D����
C. ����D�γɵĻ�������DԪ�س�����̬
D.�Ƚ���Ԫ�ص�������������ʱ�õ��ӵ���Ŀ
(4)��Ѫ����һ�������仯ѧʽΪK4[E(CN)6]��3H2O����Ѫ����Һ��ϡ�������ʱ������������ԭ��Ӧ�����������κ�һ��������廥Ϊ�ȵ��������̬������÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
(5).ͭ������±��(SCN)2��Ӧ����Cu(SCN)2��1mol(SCN)2�����к��ЦҼ�����ĿΪ_____����±��(SCN)2��Ӧ���������֣�������������(H��S��C��N)�ķе������������(H��N=C=S)�ķе㣬��ԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2NO2(g)![]() 2NO(g)+O2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־��( )
2NO(g)+O2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
�ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO
����NO2��NO��O2��ʾ�ķ�Ӧ����֮��Ϊ2��2��1��״̬
�ܻ���������ɫ���ٸı��״̬ �ݻ��������ܶȲ��ٸı��״̬
��������ѹǿ���ٸı��״̬ ��������ƽ����Է����������ٸı��״̬
A. �٢ܢޢ� B. �ڢۢݢ� C. �٢ۢܢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�����ӿ�ʼ���ڹر�״̬,��Һ��A�����Թܢ�������B��ַ�Ӧ�����ӣ��ɷ����Թܢ��ڵ�ˮ���̷����ˡ���Һ��A������B����ϲ�����(����)
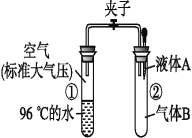
A. NaOH��Һ��CO2 B. H2O������
C. NaOH��Һ��CO D. H2O��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�û������˵����ȷ���ǣ� ��
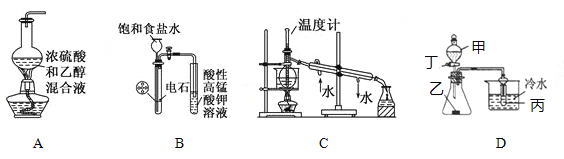
A. ʵ��������ϩ
B. ʵ��������Ȳ����֤��Ȳ�ܷ���������Ӧ
C. ʵ�����з���ʯ��
D. ����Ϊ���ᣬ��Ϊ����(��״),��Ϊ��������Һ�����װ�ò�������֤���ᡢ̼�ᡢ�������Ե�ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�һ��������(Cl2O)Ϊ�ػ�ɫ���壬�е�Ϊ3.8 �棬42 �����ϻ�ֽ�����Cl2��O2��Cl2O������ˮ����ˮ��Ӧ����HClO��
���Ʊ���Ʒ��
�������Ϳ���(�����뷴Ӧ)�������1��3���ͨ�뺬ˮ8%��̼�������Ʊ�Cl2O������ˮ����Cl2O(����Cl2)�Ʊ���������Һ��

��1����װ�õ�����˳��Ϊ___��___��___��________��____��___________
��2��װ��B�ж�����ݺͽ������������_��װ��C��������__��
��3���Ʊ�Cl2O�Ļ�ѧ����ʽΪ___��
��4����Ӧ�����У�װ��B�������ˮ�У���Ŀ����___��
��5���˷��������������ֱ������ˮ�Ʊ���������Һ��������Ҫ�ŵ㣬�ֱ���____��
���ⶨŨ�ȣ�
��6����֪������ɱ�FeSO4�����ʻ�ԭ��������ʵ�鷽���ⶨװ��E������Һ�д���������ʵ���Ũ�ȣ���ȡ10 mL������������Һ����ϡ����100 mL���ٴ�����ȡ��10.00 mL����ƿ�У�������10.00 mL 0.80 mol��L��1��FeSO4��Һ����ַ�Ӧ����0.050 00 mol��L��1������KMnO4��Һ�ζ����յ㣬����KMnO4��Һ24.00 mL����ԭ��������Һ��Ũ��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A. �ڱ�״���£�11.2L O2��22.4L NO��ϲ���ַ�Ӧ��õ�������ķ�����ΪNA
B. ������0.1mol��L��1NH4NO3��Һ�еĵ�ԭ����Ϊ0.2NA
C. 1mol Na������O2��Ӧ������Na2O��Na2O2�Ļ���ת�Ƶĵ�����ΪNA
D. 25��ʱ��1.0L pH��13��Ba(OH)2��Һ�У����е�OH����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp[Mg(OH)2]=1.1��10-11�� Ksp(AgCl)=1.8��10-10��Ksp(Ag2CrO4)=1.9��10-12��������������ȷ������ ��
A. Ũ�Ⱦ�Ϊ2��10-5mol/L��AgNO3��Һ��NaCl��Һ�������ϣ��а�ɫ��������
B. ��0.001mol/L��AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001mol/L��KCl��K2CrO4�����Һ�У��Ȳ���AgCl����
C. c(Mg2+)Ϊ0.11mol/L����Һ��Ҫ����Mg(OH)2��������Һ��pHҪ������9����
D. ������������ʱ����Ag2CrO4ˮ��Һ�м�������K2CrO4��������Һ��c(Ag+)����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com