
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
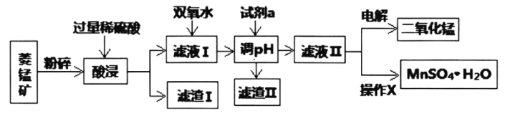
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
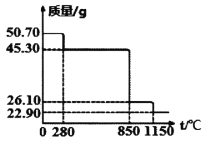
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
【答案】MnCO3 Fe(OH)3 、Cu(OH)2 蒸发浓缩,冷却结晶,过滤 6.7≤pH<7.2 10.0 Mn2++2H2O-2e-=MnO2+4H+ MnO2 3MnO2![]() Mn2O4+O2
Mn2O4+O2![]()
【解析】
Ⅰ.菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入试剂双氧水,将溶液中Fe2+氧化为Fe3+,加入试剂a为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,铜离子转化为氢氧化铜沉淀,过滤除去,滤液2中加入试剂硫酸和氯酸钾,3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,根据电解原理进行回答判断.
Ⅱ.根据质量守恒和原子守恒计算判断;根据锰、氧元素质量守恒分析产物,书写1150℃时,反应的化学方程式。
(1)调pH时,该试剂可与氢离子反应,且不引入新的杂质,所以可用MnCO3;加入试剂a为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,铜离子转化为氢氧化铜沉淀,滤渣Ⅱ的成分是Cu(OH)2、Fe(OH)3;滤液Ⅱ经蒸发浓缩,冷却结晶,过滤洗涤、低温烘干后的到硫酸锰晶体;
故答案为:MnCO3;Fe(OH)3 、Cu(OH)2;蒸发浓缩,冷却结晶,过滤;
(2)为确保除尽铁离子、铜离子杂质而又不损失锰,根据图表可知pH的调整范围为:6.7≤pH<7.2;设Mn2+完全沉淀时溶液中成c(OH-)=amol/L,根据Ksp的定义可知此时a2×10-5=1.0×10-13,解得a=10-4mol/L,即pH=10,
故答案为:6.7≤pH<7.2;10.0;
(3)用电解法制备MnO2时,阳极上发生失电子的氧化反应,其电极反应式为:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
Ⅱ.(1)50.70gMnSO4H2O样品n(锰)=n(MnSO4H2O)=0.3mol,其中n(H2O)=0.3mol,m(H2O)=5.4g,280℃时,所得固体质量为45.30g,减少的质量为5.4g,则说明该段失去结晶水,此时固体为:MnSO4,继续受热分解生成锰的氧化物和硫的氧化物0.3mol,850℃时,固体质量由45.30g减少到为26.10g,减少的质量为19.2g,则硫氧化物的相对质量为64,故为二氧化硫,则此时的固体为MnO2,
故答案为:MnO2;
(2)1150℃时固体为为二氧化锰分解所得,锰元素质量守恒,则m(锰)=n(锰)×55=16.50g,则氧化物中m(O)=22.90g-16.50g=6.4g,n(O)=0.4mol,故n(Mn):n(O)=0.3:0.4=3:4,则该氧化物为:Mn3O4,故反应为: 3MnO2![]() Mn2O4+O2
Mn2O4+O2![]() ,
,
故答案为:3MnO2![]() Mn2O4+O2
Mn2O4+O2![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是
A.苯与浓硝酸、浓硫酸共热并保持![]() 反应生成硝基苯
反应生成硝基苯
B.用![]() 与
与![]() 发生酯化反应,生成的有机物为
发生酯化反应,生成的有机物为![]()
C.苯乙烯在合适条件下催化加氢可生成乙基环己烷
D.戊烷![]() 的一溴取代物共有8种
的一溴取代物共有8种![]() 不含立体异构
不含立体异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,

现用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是__________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 __________________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是_______________。
(3)在装置C中应加入NaOH溶液,其目的是____________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法 ______________。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置分层、分液后,若产物中有少量未反应的Br2,最好用______________洗涤除去;若产物中有少量副产物乙醚,可用________(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是________________。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(![]() )电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:

下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有![]() 、
、![]() 、
、![]()
C.“沉淀”反应的金属离子为![]()
D.上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aA(g)+bB(g) cC(g)△H = Q 在密闭容器中进行,在不同温度(T1 和 T2 )及压强(P1 和 P2 )下,混合气体中 B 的质量分数 w(B)与反应时间(t)的关系如图所示,下列判断正确的是 ( )
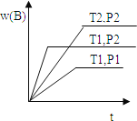
A.T1<T2,P1<P2,a+b>c,Q<0
B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0
D.T1>T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解饱和食盐水的装置。(a、b均为碳棒)
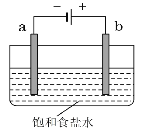
(1)a极的名称是__极,反应式为__。
(2)b极的电极反应式为__,发生__反应。
(3)写出电解饱和食盐水的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:![]()
![]()
![]()
![]()
由甲烷制氢气的一个缺点是________。
(3)将![]() 进行热分解也可以制得氢气
进行热分解也可以制得氢气![]()
![]() 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分![]() 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金(![]() )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的![]() 、
、![]() 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为![]() 得到的混合物
得到的混合物![]() 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金(![]() )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的![]() 的
的![]() 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出![]() 。
。![]()
![]() 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出![]() 的物质的量为________。
的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下
![]()
下列说法不正确的是( )。
A.C12H22O11属于二糖B.1mol葡萄糖可分解成3mol乙醇
C.可用碘水检验淀粉是否完全水解D.不能用分液操作分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
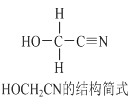
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com