
【题目】已知某反应aA(g)+bB(g) cC(g)△H = Q 在密闭容器中进行,在不同温度(T1 和 T2 )及压强(P1 和 P2 )下,混合气体中 B 的质量分数 w(B)与反应时间(t)的关系如图所示,下列判断正确的是 ( )
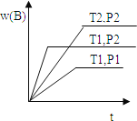
A.T1<T2,P1<P2,a+b>c,Q<0
B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0
D.T1>T2,P1>P2,a+b>c,Q<0
科目:高中化学 来源: 题型:
【题目】中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )
A. 甲醇低温所制氢气用于新能源汽车
甲醇低温所制氢气用于新能源汽车
B. 氘、氘用作“人造太阳”核聚变燃料
氘、氘用作“人造太阳”核聚变燃料
C. 偏二甲肼用作发射“天宫二号”的火箭燃料
偏二甲肼用作发射“天宫二号”的火箭燃料
D.![]() 开采可燃冰,将其作为能源使用
开采可燃冰,将其作为能源使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应2NO2(g)![]() N2O4(g)。下列所给量不再变化表明该反应已达平衡状态的是( )
N2O4(g)。下列所给量不再变化表明该反应已达平衡状态的是( )
A.混合气体的压强B.混合气体的质量
C.混合气体的密度D.混合气体各组分的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法不正确的是( )

A.该装置构成了电解池
B.铁腐蚀过程中化学能转化为电能
C.活性炭在该装置中并无实际作用
D.正极电极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
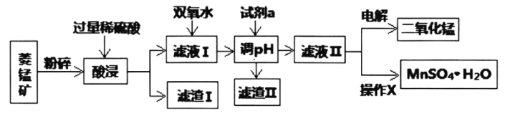
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
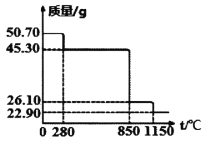
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为________热反应,且m+n________p(填“>”、“=”或“<”)。
以下各题填“增大”、“减小”或“不变”
(2)若加入催化剂,平衡时气体混合物的总物质的量________。
(3)若体积不变加入B,则A的转化率________,B的转化率________。
(4)减压时,A的质量分数________;增压时,B的质量分数________。
(5)若升高温度,则B的浓度________,平衡时B、C的浓度之比![]() 将________。
将________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)达到新平衡时混合物颜色________;若压强不变,则加入C达到新平衡时混合物颜色________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.如图可表示水分解过程中的能量变化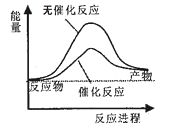
B.若2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) ΔH=-a kJ/mol,
Ⅱ:键能H-H:b kJ/mol,Cl-Cl:c kJ/mol。则断开1 mol H-Cl键所需能量为![]() kJ
kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com