
如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为NaOH(aq)或KOH(aq)时〕两种。试回答下列问题:

(1)酸式电池的电极反应:负极_______________,正极______________;电池总反应:________________;
电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极_________________,正极_________________;电池总反应:______________;电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
(1)2H2-4e-=4H+ O2+4e-+4H+=2H2O 2H2+O2=2H2O 变大
(2)2H2-4e-+4OH-=4H2O O2+4e-+2H2O=4OH- 2H2+O2=2H2O 变小
【解析】(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在;酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2和O2生成水的反应,由于有水生成,溶液将逐渐变稀,故pH增大。
(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池总反应也是H2和O2生成水的反应。同样,由于有水生成,c(OH-)变小,pH变小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014学年高二鲁科选修3化学规范训练1.1.2原子核外电子运动练习卷(解析版) 题型:选择题
首次将量子化概念应用到原子结构,并解释了原子的稳定性的科学家是( )。
A.道尔顿 B.爱因斯坦 C.玻尔 D.普朗克
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.3.2反应限度条件的控制练习卷(解析版) 题型:填空题
t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)  2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
(3)t2 ℃时,若将物质的量之比n(SO2)∶n(O2)=1∶1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.3.1化学反应的速率练习卷(解析版) 题型:选择题
已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为2 mol·L-1·s-1,则此段时间内用B的浓度变化表示的化学反应速率为( )。
A.5 mol·L-1·s-1 B.6 mol·L-1·s-1 C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.3.1化学反应的速率练习卷(解析版) 题型:选择题
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为( )。
A.v(NH3)=0.01 mol·L-1·s-1 B.v(O2)=0.001 mol·L-1·s-1
C.v(NO)=0.001 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.2.2发展中的化学电源练习卷(解析版) 题型:填空题
Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2?NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是______________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.2.1化学能转化为电能练习卷(解析版) 题型:选择题
试根据氧化还原反应:2FeCl3+Cu=2FeCl2+CuCl2设计原电池,并画出装置图。
指出电解质溶液是________________,负极是________________,电极反应式为__________________,正极是___________,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.1化学能与热能练习卷(解析版) 题型:选择题
下列说法正确的是 ( )。
A.任何化学反应都伴随着能量的变化
B.H2O(g)―→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
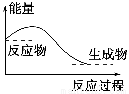
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.2.2元素周期表周期律的练习卷(解析版) 题型:填空题
制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH3、CH3Cl等作制冷制,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律来开发新的制冷剂。根据已有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
SiH4>PH3>H2S>HCl,则________>________>H2O>HF(填物质的化学式)。
(2)化合物的毒性:
PH3>NH3,CCl4>CF4,则H2S________H2O,CS2________CO2(填“>”“=”或“<”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8 ℃,CF4的沸点为-128 ℃,新的制冷剂的沸点范围应介于二者之间,经过较长时间的反复实验,发现了制冷剂CF2Cl2(氟利昂),其他类似的制冷剂可以是________。
(4)然而这种制冷剂造成的当今某一环境问题是_____________________________。
但求助于周期表中元素及其化合物的______(填写下列选项的编号)变化趋势开发制冷剂的科学思维方法是值得借鉴的。
①毒性;②沸点;③易燃性;④水溶性;⑤颜色
A.①②③ B.②④⑤ C.②③④ D.①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com