
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
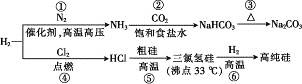
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
【答案】B
【解析】
A.根据氮的固定含义判断;
B.根据物质的溶解性及反应产生的HCO3-浓度大小判断气体通入先后顺序;
C.根据氧化还原反应的特征判断反应类型;
D.根据物质的沸点的高低判断提纯方法。
A.N2与H2在一定条件下合成NH3气,是氮元素的单质变为化合物的过程,因此属于氮的固定,A正确;
B.CO2在室温下在饱和食盐水中溶解度不大,若先通入CO2,后通入NH3,则反应产生的HCO3-离子浓度较小,最后得到的NaHCO3就少,或根本不产生NaHCO3固体,而NH3易溶于水,先通入NH3使溶液呈碱性,有利于CO2的吸收,因此要先向饱和食盐水中通入足量NH3,再通入CO2气体,B错误;
C.反应⑤、⑥中均匀元素化合价的变化,因此这两个反应均为氧化还原反应,C正确;
D.由于三氯氢硅沸点只有33℃,比较低,与其它杂质的沸点不同,因此可通过蒸馏的方法分离提纯,分馏方法也叫精馏,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1, 2-二溴乙烷,下列转化方案中最好的是
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH3
CH2BrCH3![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,有强还原性。已知:①2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,②H3PO2+NaOH(足量)=NaH2PO2+H2O。下列推断不正确的是
A. H3PO2的结构式为
B. H3PO2具有强还原性,在空气中可能被氧化成磷酸
C. NaH2PO2是酸式盐
D. 每消耗1mol P4,反应①中转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
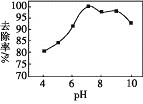
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末X,由BaCl2、K2SO4、CaCO3、NaOH、CuCl2、KCl中的一种或几种组成,为了探究其成分,进行了如下实验:

下列判断正确的是
A. 白色滤渣A可能为CaCO3、BaSO4的混合物
B. K2SO4、CuCl2一定不存在
C. KCl、K2SO4可能存在
D. CaCO3、BaCl2一定存在,NaOH可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。下列叙述错误的是:

A. 上述流程中可用NaHSO4代替NaHCO3
B. 从易拉罐中可回收的金属元素有Al、Fe
C. 合理处理易拉罐有利于环境保护和资源再利用
D. “沉淀”反应的金属离子为Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com