
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
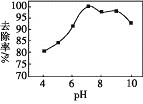
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
【答案】10Ca2++8OH-+6HPO42-=Ca10(PO4)6(OH)2↓+6H2O 2NO3-+5H2+2H+![]() N2+6H2O CO2溶于水后呈酸性,可以提供H+,有利于pH维持在4.0~6.0 5∶1 pH大于9时,ClO-的氧化性减弱,不利于氧化NH3
N2+6H2O CO2溶于水后呈酸性,可以提供H+,有利于pH维持在4.0~6.0 5∶1 pH大于9时,ClO-的氧化性减弱,不利于氧化NH3
【解析】
(1)Ca(OH)2与HPO42-反应产生Ca10(PO4)6(OH)2沉淀和水;
(2)①在pH为4.0~6.0的酸性条件下,H2将NO3-还原为N2,CO2溶于水会电离产生H+,便于H2还原NO3-;
②在pH约为5时,纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,根据电子守恒配平方程式,可得该反应中氧化产物与还原产物的物质的量之比;
(3)根据ClO-氧化性与溶液的pH关系分析。
(1)Ca(OH)2与HPO42-反应产生Ca10(PO4)6(OH)2沉淀和水,根据电荷守恒、原子守恒,可得该反应的离子方程式为10Ca2++8OH-+6HPO42-=Ca10(PO4)6(OH)2↓+6H2O;
(2)①在pH为4.0~6.0的酸性条件下,具有还原性的H2可以将NO3-还原为N2,反应的离子方程式为:2NO3-+5H2+2H+![]() N2+6H2O ;若H2中混有CO2,CO2溶于水反应产生的H2CO3发生电离作用,会电离产生H+,有利于pH维持在4.0~6.0,便于H2还原NO3-;
N2+6H2O ;若H2中混有CO2,CO2溶于水反应产生的H2CO3发生电离作用,会电离产生H+,有利于pH维持在4.0~6.0,便于H2还原NO3-;
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,根据电子守恒、原子守恒和电荷守恒,可得该反应的化学方程式为:5Fe+12H++2NO3-=5Fe2++N2↑+6H2O,根据方程式可知:在该反应中氧化产物Fe2+与还原产物N2的物质的量之比为5:1;
(3)ClO-具有强的氧化性,溶液的pH越小,ClO-氧化性越强,pH越大,ClO-的氧化性越弱。当pH大于9时,溶液进行较强,则ClO-的氧化性减弱,不利于氧化NH3。


科目:高中化学 来源: 题型:
【题目】用氢氧化钠固体配制溶液的过程:称取10.0 g氢氧化钠固体,在烧杯中加水搅拌溶解后,用如图所示的容量瓶来配制氢氧化钠溶液,回答下列问题:
(1)______(填“能”或“不能”)将溶解后的氢氧化钠立即转移到容量瓶中。
(2)所配制的氢氧化钠溶液的物质的量浓度是_______molL-1.
(3)取出所配制的溶液10 mL,加水稀释至500 mL,稀释后溶液溶质的物质的量浓度是_______mol L-1.
(4)将CO2通入氢氧化钠溶液(过量)中,写出发生反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制250 mL 0.1 mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250 mL 0.1 mol/L的盐酸溶液,需要量取浓盐酸的体积是_____mL(精确到0.1);
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________;
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________,溶液注入容量瓶前需恢复到室温,这是因为__________。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作________;若加蒸馏水时不慎超过了刻度________;若定容时俯视刻度线________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度____________;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
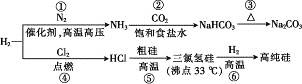
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列各组物质中,分子数相同的是( )
A.9g H2O 和 0.5NA 个 CO2
B.2L CO 和 2L CO2
C.标准状况下 ,1mol O2 和 22.4LCCl4
D.2g H2和标准状况下 2.24L HCl 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列事实能说明醋酸是弱电解质的组合是__________(填序号)。
①醋酸与水能以任意比互溶 ②用醋酸溶液做导电实验,灯泡很暗
③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸溶液的pH为4
⑤醋酸能和碳酸钙反应放出CO2
(2)已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是____________(填序号)
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是____________(填序号)
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸 三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。(用序号表示,下同)
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
③当三者c(H+)相同且体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠的原子结构示意图________。
钠与水反应的实验过程如图①、②、③所示。
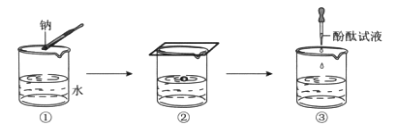
①将图②中的现象与解释用直线连接起来。_________
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈_______(填“酸”或“碱”或“中”)性。
③钠与水反应的化学方程式是_________。
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式___,与二氧化碳反应的化学方程式___。
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:
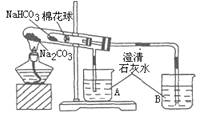
加热一段时间后,________(填“A”或“B”)中澄清石灰水变浑浊,写出澄清石灰水变浑浊的离子方程式:________。写出试管中发生反应的化学方程式________。
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。
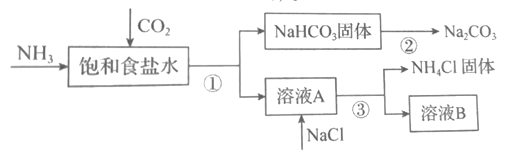
①联合制碱法所制得的“碱”是指_______(填化学式)。
②在①-③所涉及的操作方法中,包含过滤的是_______(填序号)。
③根据图,将化学方程式补充完整:NH3+CO2+___+___=NaHCO3↓+NH4Cl
④NaHCO3溶于水电离的方程式___。
⑤下列说法中,正确的是___(填字母)
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W__________、X__________、Y__________、Z__________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是____________(写化学式),还原剂是____________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________。
②化学方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com