
【题目】列各组物质中,分子数相同的是( )
A.9g H2O 和 0.5NA 个 CO2
B.2L CO 和 2L CO2
C.标准状况下 ,1mol O2 和 22.4LCCl4
D.2g H2和标准状况下 2.24L HCl 气体
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应:
甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细观察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
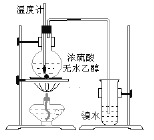
(1)写出甲同学实验中认为达到实验目的的两个反应的化学方程式:____________________________、___________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):____________________
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。
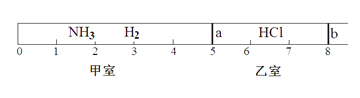
(1)甲室中气体的物质的量为______________。
(2)甲室中气体的质量为_______________。
(3)甲室中NH3,H2的物质的量之比为_________________。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3充分反应后,活塞b将位于刻度“_____________”处(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为____________mol/L
(2)应量取63%的浓硝酸_____________mL,应选用___________。(填仪器的字母编号)
(3)实验时还需选用的仪器有______________(填仪器的字母编号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是______(填序号)。 |
A.可以按此建议改进,便于使用容量瓶 |
B.不能按此建议改进,因为会降低容量瓶的精确度 |
C.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
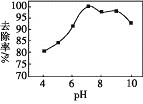
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 称量NaCl固体时砝码上有杂质
B. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
C. 定容时加水加多了,用滴管吸出溶液至刻度线
D. 定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置。
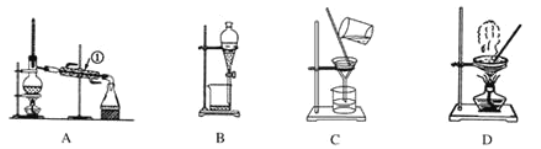
利用以上装置,可以按以下实验方案从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。(已知甲苯和甲醇均为有机溶剂,有机物大多能互溶)
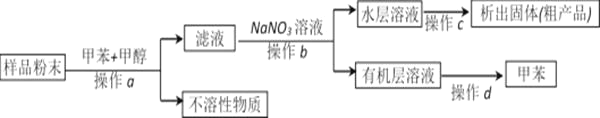
(1)装置A中仪器①的冷却水下进上出的目的是________________________________,使用装置A的操作是__________(填“a”、“b”、“c”或“d”,下同)。
(2)使用装置B的操作是_______(填“a”、“b”、“c”或“d”),使用分液漏斗前应该先_________。
(3)装置C的玻璃棒作用是___________,若所得沉淀不溶于水且需要洗涤,则洗涤的具体操作是________________________________________________________________________________。
(4)使用装置D的操作是_________(填“a”、“b”、“c”或“d”),该操作中玻璃棒的作用是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制480mL0.2mol·L-1的NaOH溶液。
(1)通过计算可知,应用托盘天平称量_____克NaOH固体。
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯外还有_____。
(3)从下面选出所需的操作并写出正确的顺序_____(填字母)。
A.洗涤 B.冷却 C.量取 D.称量 E.定容 F.转移溶液 G.稀释 H.溶解
(4)在实验过程中出现如下情况对所配溶液的浓度有何影响(填“偏高”或“偏低”或“无影响”)。
①定容时加蒸馏水不慎超过了刻度_____;
②容量瓶不干燥,有一定的水分_____;
③定容时仰视观察到液面刚好到达刻度线_____。
(5)该NaOH溶液与2.24L氯气(STP)下恰好完全反应,需氢氧化钠溶液_____mL。
(6)用18mol·L-1的硫酸配制100mL1.0 mol·L-1硫酸,实验时应选用的仪器是_____(填编号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com