
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W__________、X__________、Y__________、Z__________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是____________(写化学式),还原剂是____________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________。
②化学方程式:__________________。
【答案】(1)NaHCO3;Na2CO3;NaOH;Na2O2;
(2)②③;Na2O2;Na2O2;
(3)CO32﹣+Ca2+=CaCO3↓,K2CO3+CaCl2=CaCO3↓+2KCl.
【解析】
(1)根据框图所示的内容,钠的化合物中,受热能分解生成三种产物的是碳酸氢钠,所以W是碳酸氢钠,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,所以X是碳酸钠,能和二氧化碳以及水反应生成氧气的是过氧化钠,所以Z是过氧化钠,故答案为:NaHCO3;Na2CO3;NaOH;Na2O2;
(2)以上4个化学反应中,反应2Na2O2+2CO2=2Na2CO3+O2↑和2Na2O2+2H2O=4NaOH+O2↑中有元素化合价的变化,属于氧化还原反应,两个反应中化合价变化的均是过氧化钠中的氧元素,所以过氧化钠既是氧化剂又是还原剂;
(3)碳酸钠和氢氧化钙反应的离子方程式为:CO32-+Ca2+=CaCO3↓,此外该离子反应还可以表示氯化钙和碳酸钾之间的反应,即K2CO3+CaCl2=CaCO3↓+KCl。


科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:

(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式),该气体分子中极性键的数目为___________;“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屈昔多巴( ![]() )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线(
)是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( ![]() 简写为BnCl,
简写为BnCl, ![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_________,其作用为_____________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有_____个手性碳原子。
(3)反应②为加成反应,则有机物X的名称为________________。
(4)![]() 显________性(填“酸”、“中”或“碱”)。
显________性(填“酸”、“中”或“碱”)。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线: __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,下图所示是从铝土矿中制备铝的工艺流程:

已知:溶液中硅酸钠与偏铝酸钠反应能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH。下列说法不正确的是
A. 滤渣A的成分为Na2Al2Si2O8和Fe2O3
B. 用过量CO2酸化,生成Al(OH)3的反应:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 过滤操作时,用玻璃棒搅拌,可以加快过滤速度
D. 灼烧操作前,坩埚需先洗净,再擦干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
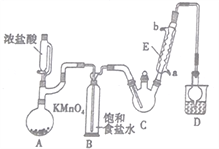
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验的描述不正确的是

A. 图(a)根据检流计(G)中指针偏转的方向比较Zn、Cu 的金属活泼性
B. 图(b)根据导管中液面的变化判断铁钉发生了析氢腐蚀
C. 图(c)根据温度计读数的变化测定稀HCl和稀NaOH溶液的反应热
D. 图(d)根据两只烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)的热效应
N2O4(g)的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铝合金是以Zn、Al 为主,Cu、Mg为辅的多元化合金。测定其中Cu含量的实验步骤如下:
①称取该合金样品1.100 g,用稀H2SO4和H2O2溶解后煮沸除去过量H2O2,残液定容于250mL容量瓶中;
②用移液管移取50.00mL配制液于250mL碘量瓶中,调节溶液的pH=3~4,加入过量KI溶液2Cu2++4I-=2CuI↓+I2)和3-4滴淀粉溶液;
③用1.100x10-2mol/LNa2S2O3溶液滴定生成的I2至终点(I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL。
请回答:
(1)步骤①中溶解Cu的离子方程式___________________。
(2)步骤③中判断滴定终点的方法_______________________。
(3)合金中Cu的质量分数_____________。(结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中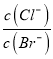 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com