
【题目】实验室用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制250 mL 0.1 mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250 mL 0.1 mol/L的盐酸溶液,需要量取浓盐酸的体积是_____mL(精确到0.1);
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________;
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________,溶液注入容量瓶前需恢复到室温,这是因为__________。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作________;若加蒸馏水时不慎超过了刻度________;若定容时俯视刻度线________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度____________;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_________。
【答案】2.1 BCAFED 保证溶质全部转入容量瓶 容量瓶盛放热溶液时,体积不准确 偏低 偏低 偏高 倒掉重新配制 倒掉重新配制
【解析】
(1)先根据c=![]() ,计算出浓盐酸的物质的量浓度,然后根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;
,计算出浓盐酸的物质的量浓度,然后根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;
(2)根据配制一定物质的量浓度的溶液的实验操作进行排序;
(3)根据m=nM及c=![]() 分析操作目的;结合容量瓶的使用分析;
分析操作目的;结合容量瓶的使用分析;
(4)根据m=nM及c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断.
分析操作对溶质的物质的量或对溶液的体积的影响判断.
(5)只要配制的溶液浓度与要求的不一致,就必须重新配制。
(1)浓盐酸的物质的量浓度为:c=![]() =11.8mol/L,设所需浓盐酸的体积为V,则有V×11.8mol/L=0.1mol/L× 0.25L,解得V=0.0021L=2.1mL;
=11.8mol/L,设所需浓盐酸的体积为V,则有V×11.8mol/L=0.1mol/L× 0.25L,解得V=0.0021L=2.1mL;
(2)配制一定物质的量浓度的溶液步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作,正确的操作顺序为:BCAFED;
(3)如果不把洗涤液均移入容量瓶,则会造成溶质的损失,导致溶液浓度偏低,故将洗涤液都移入容量瓶的目的是保证溶质全部转入容量瓶;
溶液体积会热胀冷缩,如果不冷却即移液并定容,则溶液体积冷却后偏小,浓度偏高;
(4)若没有进行A操作,烧杯和玻璃棒上都有残留的溶质,会使溶质的物质的量减少,导致配制的溶液浓度偏低;
若加蒸馏水时不慎超过了刻度线,使溶液的体积偏大,导致配制的溶液浓度偏低;若定容时俯视刻度线读数,加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高;
(5)加蒸馏水时不慎超过了刻度,导致配制的溶液浓度偏低,需要进行的操作是倒掉溶液重新配制;
向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,导致溶质物质的量减少,使配制的溶液浓度偏低,需进行的操作是倒掉溶液重新配制。


科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol L-1的H2SO4溶液中,乙同学将电极放入6mol L-1NaOH的溶液中,如图所示。
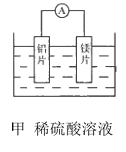
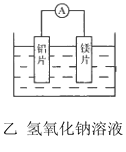
(1)写出甲电池中正极的电极反应式:________.
(2)写出乙电池中总反应的离子方程式:_________.
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______(填写元素符号,下同)的金属活动性更强,而乙会判断出___的金属活动性更强。
(4)由此实验,可得到如下哪些正确结论(______)
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属活动性不一定比铝的金属活动性强
C.该实验说明金属活动性顺序已过时,已没有使用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)将5.1g镁铝合金溶于60 mL5.0 mol L-1H2SO4溶液中,完全溶解后再加入65mL10.0mol L-1的NaOH溶液,得到沉淀质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入____mLNaOH溶液时,可使溶解在硫酸中的Mg2+和Al3+恰好完全沉淀。
②计算合金溶于硫酸时所产生的氢气在标准状况下为_____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。
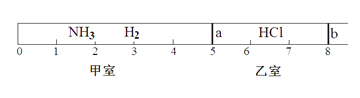
(1)甲室中气体的物质的量为______________。
(2)甲室中气体的质量为_______________。
(3)甲室中NH3,H2的物质的量之比为_________________。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3充分反应后,活塞b将位于刻度“_____________”处(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
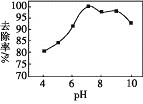
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
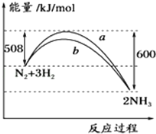
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) H=﹣92 kJ/mol
2NH3(g) H=﹣92 kJ/mol
D. 在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com