
ЁОЬтФПЁПДЮСзЫс(H3PO2)ЪЧвЛжжОЋЯИСзЛЏЙЄВњЦЗЃЌгаЧПЛЙдадЁЃвбжЊЃКЂй2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3ЁќЃЌЂкH3PO2+NaOH(зуСП)=NaH2PO2+H2OЁЃЯТСаЭЦЖЯВЛе§ШЗЕФЪЧ
A. H3PO2ЕФНсЙЙЪНЮЊ
B. H3PO2ОпгаЧПЛЙдадЃЌдкПеЦјжаПЩФмБЛбѕЛЏГЩСзЫс
C. NaH2PO2ЪЧЫсЪНбЮ
D. УПЯћКФ1mol P4ЃЌЗДгІЂйжазЊвЦ6molЕчзг
ЁОД№АИЁПCD
ЁОНтЮіЁП
A.ИљОнЂкЗДгІПЩжЊH3PO2ЪЧвЛдЊЫсЃЌгЩгкжЛга-OHЕФHдзгФмЙЛЕчРыЃЌвђДЫПЩЫЕУїH3PO2ЕФНсЙЙЪНЮЊ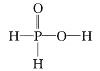 ЃЌAе§ШЗЃЛ
ЃЌAе§ШЗЃЛ
B.гЩгкPдЊЫизюИпЛЏКЯМлЪЧ+5МлЃЌЖјдкH3PO2жаPдЊЫиЛЏКЯМлЮЊ+1МлЃЌЫЕУїИУЮяжЪОпгаЧПЛЙдадЃЌдкПеЦјжаПЩФмБЛПеЦјжаЕФбѕЦјбѕЛЏГЩ+5МлЕФСзЫсЃЌBе§ШЗЃЛ
C.ИљОнAбЁЯюПЩжЊH3PO2ЪЧвЛдЊЫсЃЌЫљвдNaH2PO2ЪЧе§бЮЃЌВЛЪЧЫсЪНбЮЃЌCДэЮѓЃЛ
D.дкЂйЗДгІжадЊЫиЛЏКЯМлЩ§НЕЪ§жЕЪЧ6ЃЌЫЕУїУПга2mol P4ЗДгІЃЌЗДгІЂйжазЊвЦ6molЕчзгЃЌDДэЮѓЃЛ
ЙЪКЯРэбЁЯюЪЧCDЁЃ


 ОЋгЂПкЫуПЈЯЕСаД№АИ
ОЋгЂПкЫуПЈЯЕСаД№АИ гІгУЬтЕуВІЯЕСаД№АИ
гІгУЬтЕуВІЯЕСаД№АИ зДдЊМАЕкЯЕСаД№АИ
зДдЊМАЕкЯЕСаД№АИ ЭЌВНАТЪ§ЯЕСаД№АИ
ЭЌВНАТЪ§ЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЫсФЦ-Й§бѕЛЏЧтМгКЯЮяЕФЛЏбЇЪНПЩБэЪОЮЊxNa2SO4ЁЄyH2O2ЁЄzH2O, (ЦфжаxЁЂyЁЂzЮЊИїГЩЗжЮяжЪЕФСПЕФзюМђећЪ§БШ)ЃЌЦфЛЏбЇЪНПЩЭЈЙ§ЯТСаЪЕбщВтЖЈ:
ЂйзМШЗГЦШЁ 8.850g бљЦЗЃЌХфжЦГЩ 250mL ШмвКAЃЛ
ЂкзМШЗСПШЁ25.00mLШмвКAЃЌМгШыбЮЫсЫсЛЏЕФBaCl2ШмвКЃЌЗДгІжСГСЕэЭъШЋЃЌЙ§ТЫЁЂЯДЕгЁЂИЩдяжСКужиЃЌЕУЕНАзЩЋЙЬЬх1.165g ЃЛ
ЂлзМШЗСПШЁ25.00mLШмвКAЃЌМгШыЪЪСПЯЁСђЫсЫсЛЏКѓЃЌгУ0.02000 molЁЄL-1 KMnO4ШмвКгыH2O2ЗДгІЃЌЯћКФ0.0010 mol KMnO4ЁЃ H2O2гыKMnO4ЗДгІЕФЗНГЬЪНШчЯТЃК
2KMnO4+5H2O2+3H2SO4 =2MnSO4+5O2Ёќ+ K2SO4+8H2O
МЦЫу 8.850 g бљЦЗжаЃК
ЃЈ1ЃЉNa2SO4ЕФЮяжЪЕФСПЮЊ___________________
ЃЈ2ЃЉH2O2ЕФЮяжЪЕФСПЮЊ________________
ЃЈ3ЃЉИУСђЫсФЦ-Й§бѕЛЏЧтМгКЯЮяЕФЛЏбЇЪНЮЊ__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЌМОЮвЙњББЗНДѓВПЗжЕиЧјГіЯжЮэіВЬьЦјЃЌв§Ц№ЮэіВЕФЮЂЯИСЃзгАќКЌ(NH4)2SO4ЁЂNH4NO3ЁЂгаЛњПХСЃЮяЁЂбяГОЁЂжиН№ЪєЭЕШЁЃ
(1)NдЊЫидзгКЫЭтЕчзгдЦЕФаЮзДга___________жжЃЛЛљЬЌЭдзгЕФМлЕчзгХХВМЪНЮЊ___________ЁЃ
(2)NКЭOжаЕквЛЕчРыФмНЯаЁЕФдЊЫиЪЧ___________ЃЛSO42-ЕФПеМфЙЙаЭ___________ЁЃ
(3)ЮэіВжаКЌгаЩйСПЕФЫЎЃЌзщГЩЫЎЕФЧтдЊЫиКЭбѕдЊЫивВФмаЮГЩЛЏКЯЮяH2O2ЃЌЦфжааФдзгЕФдгЛЏЙьЕРРраЭЮЊ_________ЃЌH2O2ФбШмгкCC14ЃЌЦфдвђЮЊ___________________ЁЃ
(4)PM2.5ИЛКЌNOЃЌNOФмБЛFeSO4ШмвКЮќЪеЩњГЩХфКЯЮя[Fe(NO)(H2O)5]SO4ЃЌИУХфКЯЮяжааФРызгЕФХфЮЛЪ§ЮЊ________ЁЃ
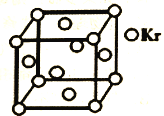
(5)ВтЖЈДѓЦјжаPM2.5ХЈЖШЕФЗНЗЈжЎвЛЪЧІТ-ЩфЯпЮќЪеЗЈЃЌІТ-ЩфЯпЗХЩфдДПЩгУ85KrЁЃвбжЊKrОЇЬхЕФОЇАћНсЙЙШчЭМЫљЪОЃЌЩшNAЮЊАЂЗќйЄЕТТоГЃЪ§ЕФжЕЃЌОЇАћБпГЄЮЊ540pmЃЌдђИУОЇЬхЕФУмЖШ_____ g/cm3(жЛСаЪНВЛМЦЫуЃЌKrФІЖћжЪСПЮЊ85gЁЄmolЁЊ1)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРызгМьбщЕФЗНЗЈе§ШЗЕФЪЧ
A. ФГШмвК![]() гаАзЩЋГСЕэЃЌЫЕУїдШмвКжагаClЃ
гаАзЩЋГСЕэЃЌЫЕУїдШмвКжагаClЃ
B. ФГШмвК![]() гаАзЩЋГСЕэЃЌЫЕУїдШмвКжагаSO42Ѓ
гаАзЩЋГСЕэЃЌЫЕУїдШмвКжагаSO42Ѓ
C. ФГШмвК![]() гаРЖЩЋГСЕэЃЌЫЕУїдШмвКжагаCu2+
гаРЖЩЋГСЕэЃЌЫЕУїдШмвКжагаCu2+
D. ФГШмвК![]() ЩњГЩЮоЩЋЦјЬхЃЌЫЕУїдШмвКжагаCO32Ѓ
ЩњГЩЮоЩЋЦјЬхЃЌЫЕУїдШмвКжагаCO32Ѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжЦШЁNa2CO3КЭИпДПSiЕФЙЄвеСїГЬШчЭМЫљЪОЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
A. ЗДгІЂйЪєгкЙЬЕЊЗДгІ
B. ВНжшЂкЮЊЯШЯђБЅКЭЪГбЮЫЎжаЭЈШыCO2жСБЅКЭКѓЃЌдйЭЈШыNH3
C. ЗДгІЂнЁЂЂоОљЮЊбѕЛЏЛЙдЗДгІ
D. гУОЋСѓЕФЗНЗЈПЩЬсДПШ§ТШЧтЙш
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДвЊЧѓЭъГЩЯТСаМЦЫу
ЃЈ1ЃЉ1mol CO2ЕФжЪСПЮЊ_________ЃЛ
ЃЈ2ЃЉБъзМзДПіЯТЃЌ11.2L NH3КЌгаЕФЗжзгЪ§ЮЊ_________ ЃЛ
ЃЈ3ЃЉ0.1mol/LЕФBaCl2ШмвКжаЃЌCl-ЕФЮяжЪЕФСПХЈЖШЮЊ__________ ЃЛ
ЃЈ4ЃЉБъзМзДПіЯТЃЌФГЦјЬхбѕЛЏЮяЕФЛЏбЇЪНЮЊRO2ЃЌ 1.28 gИУбѕЛЏЮяЕФЬхЛ§ЮЊ448 mLЃЌдђИУбѕЛЏЮяЕФФІЖћжЪСПЮЊ_______ЃЌRЕФЯрЖддзгжЪСПЮЊ________ЃЛ
ЃЈ5ЃЉ18g H2OКЌгаЕФдзгЪ§ЮЊ_________ЃЛЕчзгЪ§ЮЊ________ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГШмвКжаКЌгаНЯДѓСПЕФClЉЁЂ![]() ЁЂOHЉЕШ3жжвѕРызгЃЌШчЙћжЛШЁвЛДЮИУШмвКОЭФмЙЛЗжБ№НЋ3жжвѕРызгвРДЮМьбщГіРДЃЌЯТСаЪЕбщВйзїЫГађе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
ЁЂOHЉЕШ3жжвѕРызгЃЌШчЙћжЛШЁвЛДЮИУШмвКОЭФмЙЛЗжБ№НЋ3жжвѕРызгвРДЮМьбщГіРДЃЌЯТСаЪЕбщВйзїЫГађе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
ЂйЕЮМгMgЃЈNO3ЃЉ2ШмвКЃЛЂкЙ§ТЫЃЛЂлЕЮМгAgNO3ШмвКЃЛЂмЕЮМгBa(NO3)2ШмвК
A.ЂйЂкЂмЂкЂлB.ЂмЂкЂйЂкЂлC.ЂйЂкЂлЂкЂмD.ЂмЂкЂлЂкЂй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉжЦШЁЧтбѕЛЏЬњНКЬх
ЂйЯђжѓЗаЕФ25mLеєСѓЫЎжаж№ЕЮМгШы5~6ЕЮ_______ШмвКЃЌМЬајжѓЗажСвКЬхГЪ_____ЩЋЃЌЭЃжЙМгШШЃЌПЩжЦЕУFeЃЈOHЃЉ3НКЬхЃЌжЦШЁFeЃЈOHЃЉ3НКЬхЛЏбЇЗДгІЗНГЬЪНЮЊ_____________________ЃЎ
ЂкШЁЩйСПFeЃЈOHЃЉ3НКЬхжУгкЪдЙмжаЃЌЯђЪдЙмжаж№ЕЮЕЮМгЯЁбЮЫсЃЌБпЕЮБпеёЕДЃЎЯШГіЯжКьКжЩЋГСЕэЃЌдвђЪЧНКЬхЗЂЩњСЫ_______ЃЌЫцКѓГСЕэШмНтЃЌЕУЕНзиЛЦЩЋШмвКЃЌаДГіИУЗДгІЕФЛЏбЇЗДгІЗНГЬЪН___________________________________________ЃЎ
ЃЈ2ЃЉШчЙћFeCl3ШмвКжаКЌгаЩйСПЕФNaClЃЌвЊГ§ШЅNaClЕУЕНДПОЛЕФFeCl3ШмвКЃЌгаЯТСаЗНАИЃК

ЪдМСЂйЪЧ__________ЃЛЪдМСЂкЪЧ___________ЃЈОљЬюЛЏбЇЪНЃЉЃЛ
ЃЈ3ЃЉвбжЊЃК![]() вЊДгЗДгІКѓЕФШмвКжаЗжРыЕУЕНДПОЛЕФЕЅжЪЕтЃЌашВЩШЁЕФВйзїга________ЁЂ_________ЁЂ_________ЃЈЬюВйзїУћГЦЃЉ
вЊДгЗДгІКѓЕФШмвКжаЗжРыЕУЕНДПОЛЕФЕЅжЪЕтЃЌашВЩШЁЕФВйзїга________ЁЂ_________ЁЂ_________ЃЈЬюВйзїУћГЦЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪввдБНМзШЉЮЊдСЯжЦБИМффхБНМзШЉЕФЗДгІШчЯТЃК
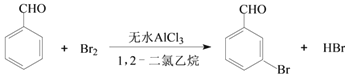
вбжЊЃК(1)МффхБНМзШЉЮТЖШЙ§ИпЪБвзБЛбѕЛЏЁЃ
(2)фхЁЂБНМзШЉЁЂ1,2-ЖўТШввЭщЁЂМффхБНМзШЉЕФЗаЕуМАЯрЖдЗжзгжЪСПМћЯТБэЃК
ЮяжЪ | фх | БНМзШЉ | 1,2-ЖўТШввЭщ | МффхБНМзШЉ |
ЗаЕу/Ёц | 58.8 | 179 | 83.5 | 229 |
ЯрЖдЗжзгжЪСП | 160 | 106 | 185 |
ВНжш1ЃКНЋвЛЖЈХфБШЕФЮоЫЎAlCl3ЁЂ1,2-ЖўТШввЭщКЭБНМзШЉГфЗжЛьКЯКѓзАШыШ§ОБЩеЦП(ШчЭМЫљЪО)ЃЌЛКТ§ЕЮМгОХЈСђЫсИЩдяЙ§ЕФзуСПвКфхЃЌПиЮТЗДгІвЛЖЮЪБМфЃЌРфШДЁЃ
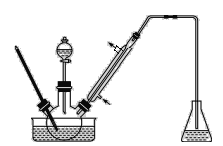
ВНжш2ЃКНЋЗДгІЛьКЯЮяЛКТ§МгШывЛЖЈСПЕФЯЁбЮЫсжаЃЌНСАшЁЂОВжУЁЂЗжвКЁЃгаЛњВугУ10% NaHCO3ШмвКЯДЕгЁЃ
ВНжш3ЃКОЯДЕгЕФгаЛњВуМгШыЪЪСПЮоЫЎMgSO4ЙЬЬхЃЌЗХжУвЛЖЮЪБМфКѓЙ§ТЫГіMgSO4nH2OОЇЬхЁЃ
ВНжш4ЃКМѕбЙеєСѓгаЛњВуЃЌЪеМЏЯргІСѓЗжЁЃ
(1)ЪЕбщзАжУжаРфФ§ЙмЕФжївЊзїгУЪЧ_________ЃЌзЖаЮЦПжагІЮЊ_____(ЬюЛЏбЇЪН)ШмвКЁЃ
(2)ВНжш1ЗДгІЙ§ГЬжаЃЌЮЊЬсИпдСЯРћгУТЪЃЌЪЪвЫЕФЮТЖШЗЖЮЇЮЊ(ЬюађКХ)_______ЁЃ
AЃЎЃО229Ёц BЃЎ58.8Ёц~179Ёц CЃЎЃМ58.8Ёц
(3)ВНжш2жагУ10% NaHCO3ШмвКЯДЕгЃЌЪЧЮЊСЫГ§ШЅШмгкгаЛњВуЕФ_______(ЬюЛЏбЇЪН)ЁЃ
(4)ВНжш3жаМгШыЮоЫЎMgSO4ЙЬЬхЕФзїгУЪЧ_____________ЁЃ
(5)ВНжш4жаВЩгУМѕбЙеєСѓЃЌЪЧЮЊСЫЗРжЙ__________________________________ЁЃ
(6)ШєЪЕбщжаМгШыСЫ5.3 gБНМзШЉЃЌЕУЕН3.7 gМффхБНМзШЉЁЃдђМффхБНМзШЉВњТЪЮЊ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com