
【题目】已知断开1molCl(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )

A.生成lmolH2(g)中的H-H键吸收436kJ能量B.H2(g)+Cl2(g)=2HCl(g) △H=-864kJ·mol-1
C.图示此反应为吸热反应D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=92.5kJ·mol-1
Cl2(g) △H=92.5kJ·mol-1
【答案】D
【解析】
A.由图中数据可知,断裂lmolH2(g)中的H-H键和lmolCl2(g)中的Cl-Cl键,需要吸热679kJ,而断开1molCl(g)中Cl-Cl键需要吸收243kJ能量,所以生成lmolH2(g)中的H-H键放出436kJ能量,A不正确;
B.H2(g) +Cl2(g)=2HCl(g) △H=(679-864)kJ·mol-1=-185kJ·mol-1,B不正确;
C.图示中,由于反应物的总能量大于生成物的总能量,所以此反应为放热反应,C不正确;
D.由B中所得反应H2(g) +Cl2(g)=2HCl(g) △H=-185kJ·mol-1,可求出HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=92.5kJ·mol-1,D正确;
Cl2(g) △H=92.5kJ·mol-1,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是:![]() 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾![]() 图乙
图乙![]()

![]() 操作一的名称是:______。
操作一的名称是:______。
![]() 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物![]() 四羟基锌酸钠
四羟基锌酸钠![]() 和
和![]() ,该配合物中心离子是______,配位数是 ______。
,该配合物中心离子是______,配位数是 ______。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
![]() 灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物![]() 和
和![]() 。
。
![]() 写出
写出![]() 与浓盐酸反应的离子方程式: ______ 。
与浓盐酸反应的离子方程式: ______ 。
![]() 取
取![]() 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气![]() ,则混合物中
,则混合物中![]() 和
和![]() 质量之比是: ______ 。
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将![]() 转化为
转化为![]() ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置![]() 图丙
图丙![]() ,将混合物粉末调成糊状,附在其中的 ______ 边电极上
,将混合物粉末调成糊状,附在其中的 ______ 边电极上![]() 填左或者右
填左或者右![]() ,该电极上发生的电极反应式是: ______
,该电极上发生的电极反应式是: ______ ![]() 在电解过程中溶液的pH将 ______填变大、变小、不变
在电解过程中溶液的pH将 ______填变大、变小、不变![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2A(g)+3B(g)![]() C(g)+4D(g),速率最快的是( )
C(g)+4D(g),速率最快的是( )
A. v(C)=0.1mol·L-1·s-1 B. v(B)=4.0 mol·L-1·min-1
C. v(A)=2.0mol·L-1·min-1 D. v(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知NaOH(aq)+HCl(aq)=![]()
![]() H=-57.3
H=-57.3![]() 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) ![]() H=-483.6
H=-483.6![]()
![]() 则氢气的燃烧热为241.8
则氢气的燃烧热为241.8![]()
C.已知![]() =
=![]()
![]() H=a
H=a![]()
![]() ===2CO(g)
===2CO(g)![]() H=b
H=b![]() 则a>b
则a>b
D.已知P(白磷,s)=P(红磷,s)![]() H<0,则白磷比红磷稳定
H<0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是_____;
(2)已知2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
2SO3(g)△H=﹣196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=___ ;
②在①的条件下,判断该反应达到平衡状态的标志是____(填字母).
a.SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)
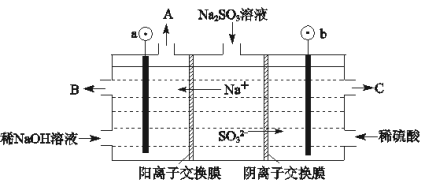
①图中a极要连接电源的(填“正”或“负”)____ 极,C口流出的物质是____;
②SO32﹣放电的电极反应式为 _________ ;
③电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为 _________ g(假设该过程中所有液体进出口密闭)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素P的结构如图所示,其中R为烷烃基。下列关于维生素P的叙述正确的是
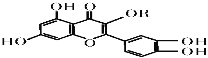
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为甲基,则该物质的分子式可以表示为C16H12O7
C.1 mol该化合物最多可消耗NaOH 为5mol
D.1 mol该化合物最多消耗溴水中的溴5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中![]() 和
和![]() 的浓度变化曲线如图所示,下列说法正确的是
的浓度变化曲线如图所示,下列说法正确的是![]()

A.升高温度,可能引起由a向b的变化
B.该温度下,水的离子积常数为![]()
C.该温度下,向水中加入![]() 固体可能引起由b向a的变化
固体可能引起由b向a的变化
D.稀释该温度下某溶液可引起由b向c的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com